Газовый закон
Cтраница 3
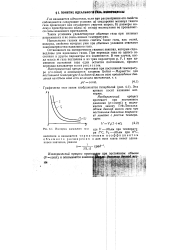 |
Изотермы идеального газа где у объем при температуре t C, V0 - объем при 0 С. [31] |
Остановимся на эмпирических газовых законах, которые справедливы для идеальных газов. При переходе газа из одного состояния в другое параметры его изменяются. В том случае, когда масса т газа постоянна и из трех параметров р, V, t при изменении состояния газа один остается постоянным, процесс перехода называется изопрецессом. [32]
Каким уравнением выражается объединенный газовый закон. [33]
Подчеркнем, что объединенный газовый закон, как и частные законы, справедлив только для постоянной массы данного газа. [34]
R - постоянная газового закона. [35]
Строгое доказательство применимости газовых законов и, в частности, закона распределения Нернста для случая дробной кристаллизации радиоактивных веществ позволяет также ответить на вопрос, отличаются ли принципиально изоморфные смеси от собственно твердых растворов, как это считал в особенности Кюстер [18], или же изоморфные смеси надо рассматривать как частный случай твердых растворов. Показанная нами применимость закона распределения Бертло-Нернста для случая дробной кристаллизации или осаждения бромидов как будто говорит в пользу последнего представления. К такому же результату пришли и Вегарт и Хауге [19], которым удалось недавно установить образование смешанных кристаллов в твердом состоянии в отсутствие воды. Применимость закона распределения, и притом в его простейшей форме, когда коэффициент распределения равняется отношению концентраций в обеих фазах, к случаю распределения радия между твердым бромистым барием и его насыщенным водным раствором требует, чтобы молекулярное состояние RaBr2 в обеих фазах было одинаково. Так как, однако, в бесконечно разведенном водном растворе бромистый барий так же, как галоидная соль любого другого металла, практически полностью ионизован, то и в кристаллах бромистого бария он должен быть в ионизованном состоянии. Другими словами, исследованием распределения радия между твердой кристаллической и жидкой фазами мы получаем доказательство того, что кристаллическая решетка соли построена не из молекул, а из ионов. Очень интересным случаем ненормального распределения радия между твердой кристаллической и жидкой фазами является изученное Дорнером и Хос-кинсом распределение радия между сульфатом бария и водой. Мы, однако, думаем, что встречающиеся здесь отклонения объясняются тем, что вследствие чересчур быстро проходящей кристаллизации равновесие по отношению к радию далеко не достигается в данном случае. Это предположение мы надеемся доказать, изменив соответствующим образом условия кристаллизации. [36]
R - постоянная газового закона. [37]
Как следует из основного газового закона, постоянство давления может быть обеспечено, если масса нагнетаемого газа будет соответствовать массовому расходу. Таким образом, при эксплуатации поршневых компрессоров регулирование давления сводится к регулированию подачи. [38]
Как известно, основных газовых законов три: 1) закон Бойля-Мариотта, 2) закон Гей-Люссака, 3) закон Авогадро-Жерара. [39]
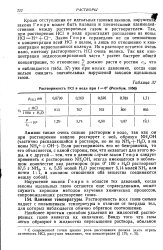 |
Растворимость НС1 в воде при 0 ( Розебум, 1856. [40] |
Кроме отступления от идеальных газовых законов, нарушен закона Генри может быть вызвано и химическими взаимодействиями между растворяемым газом и растворителем. Закон Генри справедлив не по отношению к концентрации всей НС1 в целом, а лишь по отношению к концентрации нераспавшихся молекул. Их в растворе остается очень мало, поэтому растворимость НС1 очень велика. [41]
В пределах применимости объединенного газового закона давление, объем и температура всех газов связаны друг с другом и с числом молей газа совершенно одинаковым образом. [42]
Автор: К газовым законам мы скоро перейдем. [43]
Осмотическое давление подчиняется газовым законам, поэтому для его вычисления можно воспользоваться уравнением Клапейрона - Менделеева PV RT, несколько видоизменив его. В этом уравнении V - объем раствора, который содержит 1 моль растворенного вещества. [44]
Осмотическое давление подчиняется газовым законам, поэтому для его вычисления можно воспользоваться уравнением Клапейрона - Менделеева PV - RT, несколько видоизменив его. В этом уравнении V - объем раствора, который содержит 1 моль растворенного вещества. [45]
Страницы: 1 2 3 4