Полипептид
Cтраница 1
Полипептидов из малого числа аминокислотных звеньев. [1]
Спектры полипептидов и фибриллярных белков имеют полосы амид I и II, частоты которых различны для цепей разных конформаций. [2]
Синтез полипептидов является весьма тонкой и специфической, универсальной экспериментальной задачей, требует большого искусства, знаний и навыков. В последние годы сконструированы специальные автоматические синтезаторы полипептидов и получены на них весьма сложные полипептиды: гормоны ( например, скотофобин, снимающий страх), антибиотики ( грамицидин, актиномицин), витамины. [3]
Синтез полипептидов ( белков) в клетках живых организмов протекает значительно сложнее с участием нуклеиновых кислот. [4]
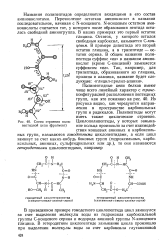 |
Схема строения полипептидной цепи ( фрагмент. [5] |
Названия полипептидов определяются входящими в его состав аминокислотами. Перечисление остатков аминокислот в названии последовательное, начиная с N-концевого. N-концевым остатком аминокислоты считается тот, у которого после образования пептида осталась свободной аминогруппа. [6]
У полипептидов много общего с белками. Водные растворы их вспениваются при встряхивании, как и у белков. Они дают целый ряд реакций, характерных для белковых веществ. [7]
Большинство полипептидов проходит через полупроницаемые перепонки, хотя многие синтезированные полипептиды обладают свойствами коллоидов. Биуретовую реакцию1 дают более сложные пептиды, начиная с некоторых трипептидов. Дипептиды этой реакции не дают. Способность полипептидов высаливаться зависит как от характера компонентов ( тирозин и цистин способствуют высаливанию), так и от порядка сочетания аминокислот в молекуле пептида. Полипептиды, особенно высокомолекулярные, проявляют в водных растворах способность к ассоциации. [8]
ДОВ полипептидов и белков с высоким содержанием а-спиралей можно описать с помощью одночленного уравнения Друде только в узком спектральном интервале. Поэтому это уравнение в настоящее время для оценки спиральности не используется и обсуждаться не будет. [9]
Образование полипептидов из а-аминокислот лежит в основе синтеза белковых веществ в организмах; к этому важному вопрЪсу мы еще вернемся ( см. стр. [10]
Функции полипептидов и протеинов в биологических системах весьма разнообразны. Они играют роль структурных компонентов, активных элементов в процессах переноса, аккумуляторов метаболической энергии, биокатализаторов и переносчиков сигналов. Несмотря на такое разнообразие функций, строение всех протеинов в значительной степени однотипно. Как и большинство биологических макромолекул, они состоят из отдельных структурных фрагментов, выбор которых и связи между ними определяют специфические свойства протеинов. Основными структурными единицами протеинов являются аминокислоты, которые объединены в одну или несколько линейных цепочек. [11]
Функции полипептидов и протеинов в биологических системах весьма разнообразны. Они играют роль структурных компонентов, активных элементов в процессах переноса, аккумуляторов метаболической энергии, биокатализаторов и переносчиков сигналов. Несмотря на такое разнообразие функций, строение всех протеинов в значительной степени однотипно. Как и большинство биологических макромолекул, они состоят из отдельных структурных фрагментов, выбор которых и связи между ними определяют специфические свойства протеинов. Основными структурными единицами протеинов являются аминокислоты, которые объединены в одну или несколько линейных цепочек. [12]
Денатурация полипептидов имеет место при длительном и значительном нагревании, при ионизирующем или ультрафиолетовом облучении, при обработке концентрированными щелочами и кислотами, а также окислительно-хлорирующими реагентами н растворами формальдегида. [13]
Синтез полипептидов, как правило, строго целенаправлен и связан g необходимостью соединения различных по природе аминокислот. Чтобы карбонильной группой одной молекулы ( превращенной, например, в хлорангидрид) ацилиро-вать аминогруппу другой по типу аминокислоты, а не себе подобной, аминогруппу ацилирующего агента предварительно защищают. С этой целью ее преобразуют в амидную, поскольку основность ( нуклеофильность) амидного атома азота значительно ниже, чем исходной аминогруппы. [14]
Секвенирование полипептидов проводят методом, известным как метод Эдмана. Последовательная обработка полипептида, имеющего свободную концевую а-аминогруппу, каким-либо алкил - или арилизотиоцианатом в слабощелочной среде приводит к образованию соответствующей тиомочевины, которая в умеренно кислой среде ( при значениях кислотности, не повреждающих пептидные связи) отщепляется в виде соответствующего тиогидантоина. [15]
Страницы: 1 2 3 4