Понижение - электронная плотность
Cтраница 1
Понижение электронной плотности вызывает обратный эффект. Однако при этом также окажется повышенной скорость реакции 7, что не является желательным, так как это приводит к понижению среднего молекулярного веса полимера. За исключением снижения скорости реакции 3, такое изменение скоростей индивидуальных реакций благоприятствует полимеризации. Реакция 3 является одной из стадий реакции роста - стадией внедрения координированного мономера в растущую цепь. Это значит, что понижение электронной плотности у Ti не должно превосходить некоторого предела, за которым скорость реакции 3 стала бы чрезмерно малой. [1]
Поэтому понижение электронной плотности, вызываемое комплексообразованием с алюминийорганическим соединением, представляющим собой кислоту Льюиса, облегчает протекание первой стадии процесса. [2]
С понижением электронной плотности на двойной связи способность мономера к координационно-анионной полимеризации падает. Об этом свидетельствуют результаты исследования Овер-бергера и Хаттаба [ 2е ] по полимеризации олефинов, содержащих трифторметильную группу, при использовании катализаторов на основе TiCl3 или VC13 и А1 - алкилов. [3]
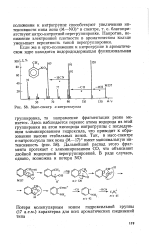 |
Масс-спектр о-нитротолуола. [4] |
Напротив, понижение электронной плотности в ароматическом кольце уменьшает вероятность такой перегруппировки. [5]
В случае бензолсульфоната понижение электронной плотности в реакционном центре, облегчающее нуклеофильную атаку, вызывается только индуктивным влиянием сульфогруппы. Поэтому реакция проходит в очень жестких условиях ( 300 - 340 С) и имеет высокую энергию активации. [6]
В приведенном примере понижение электронной плотности в реакционном центре, облегчающее нуклеофильную атаку, вызывается только индуктивным эффектом сульфогруппы. Скорость образования малоустойчивого 0-комплекса k здесь, очевидно, невелика. Рассматриваемая реакция идет по уравнению третьего порядка; это указывает на то, что k2 k - и скорость процесса лимитируется этапом отрыва сульфогруппы от ст-комплекса, при котором расходуется еще один гидроксильный ион. [7]
В случае бензолсульфоната понижение электронной плотности в реакционном центре, облегчающее нуклеофильную атаку, вызывается только индуктивным влиянием сульфогруппы. [8]
Это приводит к понижению электронной плотности на протонах по сравнению с протонами метана, так как более электроотрицательная орбиталь углерода ( с большей долей s - характера) сильнее притягивает электроны. [9]
Протонирование лиганда приводит к понижению электронной плотности связи металл - лиганд и тем самым к повышению скорости диссоциации этой связи. [10]
Координация изонитрила с катионом металла приводит к понижению электронной плотности в лиганде. Вследствие этого изонитрил приобретает способность вступать в реакции присоединения нуклеофильных агентов по кратной связи С-N. По той же причине в координированном изонитриле ослабляется связь R-NC, что облегчает возможность реакции дезалкилиро-вания. [11]
Образование донорно-акцепторной связи с металлом приводит к понижению электронной плотности в координированном ацетилене. Вследствие этого ацетилен может вступать в реакции нуклеофильного присоединения по тройной связи. [12]
Координация ацетилена с двухвалентной платиной приводит к понижению электронной плотности в ацетиленовом лиганде, вследствие чего координированный ацетилен приобретает способность вступать в реакции нуклеофиль-ного присоединения. [13]
Легкость образования псевдооснований в ряду бензимидазола является следствием понижения электронной плотности у С-атома в положении 2 имидазольного кольца в результате влияния ониевого N-атома. Электроноакцепторные свойства этого С-атома проявляются уже у свободных оснований бензимидазольного ряда ( например 6-метокси - Ьметилбензимидазол легко аминируется действием амида натрия [3]); эти свойства, естественно, усиливаются при переходе к оние-вой соли. Поэтому при действии щелочи на соль бензимидазолия ( II) ( R H) гидроксильные ионы атакуют С-атом имидазольного кольца, и другое возможное направление реакции - образование биполярного иона вследствие связывания гидроксильными ионами протона NH-группы - оказывается выключенным. [14]
Замена молекулы СО в гидрокарбониле фосфином способствует, наряду с понижением электронной плотности у атома кобальта, также и изменению стерических характеристик катализатора: появление громоздкого лиганда приводит к тому, что катализатор становится более требовательным по отношению к партнеру - олефину. Для объяснения наблюдающейся в этом случае селективности, наряду с электронным эффектом, важное значение могут иметь также и стерические трудности. [15]
Страницы: 1 2 3 4