Понижение - диэлектрическая проницаемость
Cтраница 2
Наконец, в неводных органических растворителях степень электролитической диссоциации ПАВ уменьшается симбатно с понижением диэлектрической проницаемости растворителя [26, 27], что приводит к уменьшению концентрации ионов ПАВ в растворах одинаковой аналитической концентрации при замене воды органическим растворителем. Уменьшение же концентрации ионов ПАВ в растворе смещает ионообменное равновесие в сторону перехода ПАВ из смолы в раствор. [16]
 |
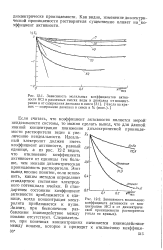
Произведение проводимости и вязкости масел, используемых для кабелей различных напряжений. [17] |
Относительно низкие величины диэлектрической проницаемости желательны для силовых кабелей, потому что с понижением диэлектрической проницаемости масла соответственно уменьшается и диэлектрическая проницаемость всей изоляции и тем самым электрическая емкость аппаратуры, а следовательно, и ее зарядный ток. [18]
Некоторые соли органических кислот, имеющие большие анионы, повышают свою растворимость при понижении диэлектрической проницаемости растворителя [6], поэтому нужно учитывать конкретно в каждом отдельном случае, ход изменения силы солен и растворимости с уменьшением диэлектрической проницаемости. Практически в большинстве случаев сила солей изменяется в меньшей степени, чем растворимость, и поэтому условия анализа в неводных растворителях в большинстве случаев лучше, чем в воде. [19]
 |
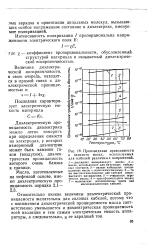
Энергетическая диаграмма реакции. [20] |
В переходном состоянии происходит некоторое рассредоточение заряда по X и Y, вследствие чего понижение диэлектрической проницаемости растворителя вызывает небольшое увеличение скорости реакций. [21]
Следует иметь в виду, что степень биполярности иона, по-видимому, должна уменьшаться при понижении диэлектрической проницаемости растворителя. [22]
Заметим, что для тонких водных прослоек между частицами монтмориллонита характерно повышение вязкости при уменьшении h [16] и понижение диэлектрической проницаемости ео. В работе [37] получены значения ео 23 - 5 - 25 для прослоек толщиной / z 5 - 8 нм. [23]
В соответствии с классической электростатической теорией высаливание неполярных органических молекул является следствием повышения энергии растворенных ионов в результате понижения диэлектрической проницаемости. [24]
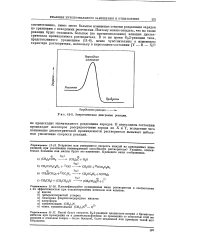
Если считать, что коэффициент активности является мерой неидеальности системы, то можно сделать вывод, что для данной ионной концентрации понижение диэлектрической проницаемости растворителя ведет к увеличению неидеальности. Идеальный электролит должен иметь коэффициент активности, равный D8 единице, а из рис. 12 - 2 видно, что отклонение коэффициента активности от единицы тем больше, чем меньше диэлектрическая проницаемость растворителя. Этот вывод вполне понятен, если вспомнить, каким методом определяют стандартное состояние электродного потенциала ячейки. В стандартном состоянии коэффициент активности приближается к единице, когда концентрация электролита приближается к нулю. [26]
 |
Зависимость моляльного коэффициента активности НС1 от концентрации НС1 и от. [27] |
Если считать, что коэффициент активности является мерой неидеальности системы, то можно сделать вывод, что для данной ионной концентрации понижение диэлектрической проницаемости растворителя ведет к увеличению неидеальности. Идеальный электролит должен иметь коэффициент активности, равный единице, а из рис. 10 - 2 видно, что отклонение коэффициента активности от единицы тем больше, чем меньше диэлектрическая проницаемость растворителя. Этот вывод вполне понятен, если вспомнить, каким методом определяют стандартное состояние электродного потенциала ячейки. В стандартном состоянии коэффициент активности приближается к единице, когда концентрация электролита приближается нулю. Значит, при бесконечном разбавлении взаимодействие. [28]
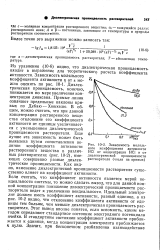
Катализ ионными парами в растворителях с низкой диэлектрической проницаемостью, Согласно уравнению (1.265), усиление ускоряющего эффекта ионной атмосферы должно коррелировать с понижением диэлектрической проницаемости среды. Однако ниже D - 40 применение этого уравнения затрудняется вследствие ассоциации ионов. [29]
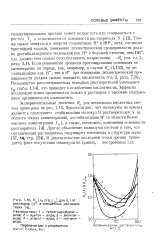 |
Я [ Ar ( NH2 J для 0 1 М растворов НС. в смешанных растворителях. [30] |
Страницы: 1 2 3 4