Понижение - диэлектрическая проницаемость
Cтраница 3
Если равновесие процесса протонирования основания не симметрично по заряду, как, например, в случае Н (1.132), то дестабилизация как ЕР, так и Н при понижении диэлектрической проницаемости должна сильно повышать кислотность ( гл. Большинство рассматриваемых неводных растворителей уменьшает ув ( табл. 1.14), что приводит к ослаблению кислотности. Эффекты ассоциации ионов проявляются только в растворах с высоким содержанием органического компонента. [31]
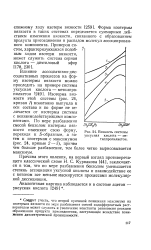 |
Вязкость системы. [32] |
Следует учесть, что второй причиной появления максимума на изотермах вязкости по мере разбавления смесей индифферентным растворителем может служить и увеличение константы равновесия реакции образования продукта присоединения, наступающее вследствие понижения диэлектрической проницаемости. [33]
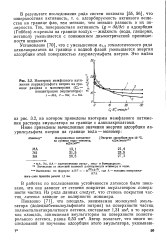 |
Изотермы межфазного натяжения лаурилсульфата натрия на границе раздела с мономерами ( Сэ - концентрация эмульгатора. [34] |
Так, поверхностная активность ( g dd / dc) и адсорбция ( Гиббса) n - крезола на границе воздух - жидкость ( вода, глицерин, метанол) уменьшается с понижением диэлектрической проницаемости жидкости. [35]
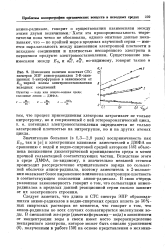 |
Изменения величин констант СТС спектров ЭПР анион-радикалов 2 - Н - заме-щенных 5-нитрофуранов в зависимости от Е., первой волны электровосстановления исходных соединений. [36] |
Значительно большая ( в 1 3 - 2 0 раза) восприимчивость как Еу так и а к электронным влияниям заместителей в ДМФА по сравнению с водой и водно-спиртовой средой авторами [46] объяснена понижением диэлектрической проницаемости среды и менее прочной сольватацией соответствующих частиц. Вследствие этого в среде ДМФА, по-видимому, в значительно меньшей степени происходит рассредоточение отрицательного заряда по сольват-ной оболочке анион-радикала, поэтому заместитель в 2-положе-нии оказывает более выраженное влияние на электронную плотность в соответствующем положении анион-радикала. В свою очередь указанная закономерность говорит о том, что сольватация анион-радикалов в пределах данной реакционной серии сильно зависит от их электронного строения. [37]
Таким образом, сорбция из растворов яблочной кислоты с увеличением содержания органического компонента должна изменяться за счет двух факторов, влияние которых имеет противоположную направленность: она должна увеличиваться за счет повышения поглотительной способности сорбента и уменьшаться за счет понижения диэлектрической проницаемости растворителя. Суммарный эффект влияния этих фактов проявляется в полученных данных. [38]
При введении органических растворителей ( метанола, этанола, этиленгликоля, глицерина и ацетона) константы скорости реакции акватации К z wc-l CoBr ( Amin) En2 ] 2 ( Amin - NH8 CH3NH2, C4H9NH2, HOC3H6NH2) резко уменьшались, что обусловлено понижением диэлектрической проницаемости D. Зависимости InKoT 1 / D являлись линейными и имели отрицательный тангенс угла наклона, что позволяет для реакции акватации этих комплексов принять непредельный механизм. [39]
Диэлектрическая проницаемость при замене воды органическими растворителями уменьшается от 80 для воды до 33 для метанола, 24 для этанола, 21 для ацетона и 2 5 для диоксана. При понижении диэлектрической проницаемости силы притяжения между ионами в растворе увеличиваются, что приводит к их ассоциации и комплексообразованию. Хорошо известная теория ионных пар Бьеррума утверждает, что ассоциация между ионами разного заряда приводит к быстрому увеличению диэлектрической проницаемости, зависящей от зарядов и радиусов ионов, до некоторой определенной критической величины. Теория Бьеррума подтверждена экспериментально; металлы, образующие хлорид-ные комплексы, значительно легче вымываются с катионитов смешанными растворами вода - ацетон и вода - спирт, содержащими 60 - 80 % органической жидкости, чем водными растворами; увеличивается, кроме того, избирательность вымывания. Так, соляная кислота вымывает с катионита кобальт, оставляя никель, а кадмий и цинк вымываются в указанном порядке раньше ионов, не образующих устойчивых хло-ридных комплексов. [40]
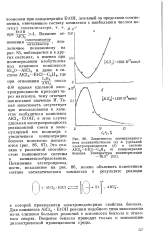 |
Зависимость молекулярного веса полиизобутилена ( а и удельной электропроводности ( б в системе А1С13 - EtCl - С6Нб от концентрации бензола. Температура полимеризации -. [41] |
Для комплекса А1С13 EtOH реакция подобного типа невозможна из-за слишком больших различий в основности бензола и этилового спирта. Введение бензола приводит только к понижению диэлектрической проницаемости среды. [42]
Уравнение предельного закона Дебая - Гюккеля не содержит индивидуальных характеристик ионов и справедливо лишь в области очень разбавленных растворов. Согласно (1.37), значения - у уменьшаются при понижении диэлектрической проницаемости растворителей. [43]
Разбавленные растворы диэтилового эфира в безводном фтористом водороде показывают высокую электропроводность, но электропроводность концентрированных растворов невысока. Это объясняется тем, что при переходе от разбавленных растворов к концентрированным относительное сродство к протону не изменяется, а это значит, что степень переноса протона и, следовательно, ионизация также не будут меняться, однако при этом вследствие понижения диэлектрической проницаемости из-за увеличения количества диэтилового эфира значительно понижается степень электролитической диссоциации. [44]
При растворении соли происходит также взаимодействие растворенных частиц с растворителем. Например, в апротонных растворителях степень сольватации галоген-анионов обратна той, которая наблюдается в водных растворах и, например, в диметилформами-де ионы хлора оказываются несольватированными. Понижение диэлектрической проницаемости приводит к усилению взаимодействия между катионами и анионами, что вызывает увеличение констант устойчивости комплексных соединений. Все эти явления коренным образом изменяют состав раствора по сравнению с составом водного раствора, содержащего те же концентрации растворенных солей. Растворитель также не является инертной средой, он входит во внутреннюю координационную сферу комплексов и адсорбируется на поверхности твердого электрода. [45]
Страницы: 1 2 3 4