Понижение - давление - пар - растворитель
Cтраница 1
 |
Эбулиоскопические Е и криоскопические К константы некоторых растворителей. [1] |
Понижение давления пара растворителя в результате растворения в нем вещества означает необходимость повышения температуры раствора для восстановления нарушенного равновесия жидкость - пар. [2]
Понижение давления пара растворителя в результате растворения в нем вещества означает необходимость повышения температуры кипения раствора для восстановления нарушенного равновесия жидкость - пар. Тогда давление насыщенного пара будет доведено до первоначального, например атмосферного. [3]
Понижение давления пара растворителя Предположим ради простоты выполнимость законов идеальных газов и обозначим через pt парциальное давление растворителя над раствором, через pio парциальное давление чистого растворителя. [4]
Понижение давления пара растворителя в результате растворения в нем вещества означает необходимость повышения температуры кипения раствора для восстановления нарушенного равновесия жидкость - пар. Тогда давление насыщенного пара будет доведено до первоначального, например атмосферного. [5]
Понижение давления пара растворителя и тедшоратуры замерзания, а также повышение температуры кипения разбавленных растворов используются для определения молекулярного веса растворенного вещества. [6]
Понижение давления пара растворителя над раствором является причиной повышения температуры кипения раствора по сравнению с температурой кипения чистого растворителя. Если же давление насыщенного пара над раствором меньше, чем над чистым растворителем, то раствор следует нагреть до более высокой температуры, чтобы возросшее давление стало бы равным внешнему давлению. Температура кипения чистого растворителя ( 7) и раствора ( Т2) определяются пересечением изображенных кривых с прямой, параллельной оси абсцисс ( температур) и соответствующей внешнему давлению рва. [7]
 |
Эбулиоскопические Е и криоскопические К константы некоторых растворителей. [8] |
Понижение давления пара растворителя в результате растворения в нем вещества означает необходимость повышения температуры раствора для восстановления нарушенного равновесия жидкость - пар. [9]
Понижение давления пара растворителя [ ад раствором с молекулярной точки зрения бъясняется тем, что присутствие в растворе олекул нелетучего растворенного вещества, гбл. [10]
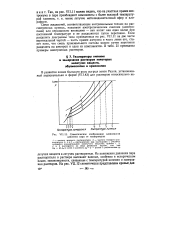 |
Схематическое изображение зависимости давления пара от температуры. [11] |
Из понижения давления пара растворителя в растворе вытекают важные, особенно в историческом плане, закономерности, связанные с температурой кипения и замерзания растворов. [12]
Следствием понижения давления пара растворителя над растворами является другая особенность этих систем, заключающаяся в повышении температуры их кипения. Кипение жидкости возможно при температуре, при которой давление ее пара достигает внешнего атмосферного давления. Так как давление пара над растворами нелетучих веществ всегда ниже давления пара чистого растворителя, то оно достигает величины внешнего давления при более высокой температуре. [13]
Непосредственное измерение понижения давления пара растворителя над раствором очень затруднительно; хотя этот способ дает удовлетворительные результаты при измерении молекулярных весов вплоть до 1000 [1-4], он неудобен для определения молекулярного веса полимеров. Трудности, связанные с такими измерениями, значительно уменьшаются при использовании изопиестического метода, при котором растворы полимера и эталонного вещества в одном и том же растворителе находятся в сосудах, соединенных между собой пространством, заполненным парами растворителя. Если давление пара над обоими растворами различно, то будет происходить перегонка растворителя из одного сосуда в другой; при постоянной температуре эта перегонка продолжается до выравнивания давлений пара над растворами. Такие растворы называются изопие-стическими. [14]
Непосредственное измерение понижения давления пара растворителя над раствором очень затруднительно, хотя этот способ может дать удовлетворительные результаты при измерении молекулярных масс вплоть до 1 тыс. Однако для полимеров он неудобен, так как слишком малы значения понижения давления пара из-за относительно небольшого числа молекул в растворе. [15]
Страницы: 1 2 3 4