Понижение - давление - пар - растворитель
Cтраница 4
На рис. 9.5 показано, каким образом понижение температуры замерзания обусловлено понижением давления пара растворителя при внесении в него растворяющегося вещества. [46]
Величина осмотического давления пропорциональна числу молекул всех веществ, растворенных в данном объеме раствора, и не зависит от природы растворенных веществ. Это же относится и к величинам известных нам других свойств разбавленных растворов, таких как понижение давления пара растворителя, понижение температуры затвердевания раствора, повышение температуры кипения. [47]
Теория электролитической диссоциации Аррениуса объяснила различие в поведении неэлектролитов и электролитов увеличением числа частиц в последних, вследствие диссоциации растворенного вещества на ионы. Этим, в частности, обусловлены более значительные изменения в электролитах свойств, связанных с понижением давления пара растворителя ( понижение температуры замерзания, повышение температуры кипения растворов и др.), а также ионная электропроводность. [48]
Диссоциация подчиняется закону действия масс. Теория электролитической диссоциации Аррениуса объяснила различие в поведении неэлектролитов и электролитов увеличением числа частиц в последних, вследствие диссоциации растворенного вещества на ионы. Этим, в частности, обусловлены более значительные изменения свойств в электролитах, связанных с понижением давления пара растворителя ( понижение температуры замерзания, повышение температуры кипения растворов и др.), а также ионная электропроводность. [49]
Из закона Рауля вытекают важные следствия, касающиеся температур кипения и замерзания растворов. Первым из таких следствий является понижение давления пара растворителя, которое приводит к повышению температуры кипения растворов. Кипение жидкости наступает при температуре, при которой давление ее насыщенного пара становится равным внешнему атмосферному рвн. Так как последнее всегда меньше, чем р, то кипение будет достигаться при более высокой температуре, чем в случае чистого растворителя. Это схематично показано на рис. V.3, где Т и Т0 - соответственно температуры кипения раствора и растворителя и TI - Т0 & ТК - повышение температуры кипения. [50]
Теперь рассмотрим на примере водного раствора поваренной соли поведение растворов при их сильном охлаждении и при кипении. При кипении ненасыщенного раствора поваренной соли происходит испарение воды и концентрация соли увеличивается. Увеличение концентрации раствора приводит к понижению давления пара растворителя над ним, и следовательно, к повышению температуры кипения его до тех пор, пока раствор не станет насыщенным. Насыщенный раствор кипит уже при постоянной температуре. [51]
Перечисленные свойства находятся в определенной взаимосвязи. Так, если мы примем одно из них за основное, то другие окажутся следствием этого основного свойства. В качестве основного свойства удобно принять понижение давления пара растворителя над раствором. [52]
Теория электролитической диссоциации в том виде, как она была сформулирована С. Аррениусом, качественно объясняет различие в поведении электролитов и неэлектролитов увеличением числа частиц в растворе вследствие диссоциации растворенного вещества на ионы. Она объясняет и различия, связанные с понижением давления пара растворителя, и такое важное свойство, как ионная электропроводность. [53]
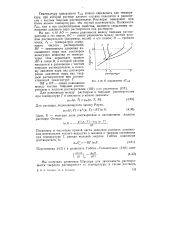 |
К определению ДГ3ам. [54] |
Температуру замерзания Тза можно определить как температуру, при которой раствор данного состава находится в равновесии с чистым твердым растворителем. Растворы замерзают при более низких температурах, чем чистый растворитель. Понижение Узам, как и все коллигативные свойства, является следствием понижения давления пара растворителя над раствором. [55]
Страницы: 1 2 3 4