Понижение - давление - пар - растворитель
Cтраница 2
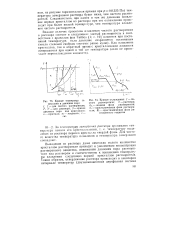
По закону Рауля понижение давления пара растворителя, обусловленное растворенным веществом, пропорционально молярной концентрации последнего и сопровождается повышением температуры кипения. Это явление лежит в основе нескольких давно разработанных методов определения молекулярных весов. Данный метод имеет следующие преимущества. Он дает возможность быстро и легко проводить измерения и учитывать при этом наличие даже самых малых полимерных молекул; в то время как осмометрия и изотермическая перегонка требуют очень строгого термо-статирования приборов, аппаратура, применяемая в эбул-лиометрии, является в некотором смысле самотермостати-рующейся, а изменение температуры и есть та величина, которая должна быть измерена. [16]
Экспериментально установлено, что понижение давления пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания, а также осмотическое давление у растворов электролитов больше, чем у растворов неэлектролитов с такой же концентрацией. [17]
От чего зависит величина понижения давления пара растворителя над раствором. [18]
Из уравнения следует, что понижение давления пара растворителя над раствором не зависит от природы растворенного вещества и определяется только его концентрацией: чем выше концентрация раствора, тем сильнее уменьшается давление пара над ним. [19]
 |
Эбулиоскопические Е и криоскопические К постоянные некоторых растворителей. [20] |
Так как для разбавленных растворов понижение давления пара растворителя пропорционально концентрации, то и повышение температуры кипения и понижение температуры отвердевания разбавленных растворов пропорциональны концентрации растворенного вещества. [21]
РАУЛЯ ЗАКОН устанавливает зависимость между понижением давления пара растворителя и количеством растворенного нелетучего вещества. [22]
Основываясь на законе Рауля, можно рассчитать понижение давления пара растворителя над раствором, а также понижение температуры замерзания и повышение температуры кипения раствора, если известна его концентрация. Закон Вант-Гоффа позволяет вычислить осмотическое давление раствора известной концентрации при данной температуре. Вычисленные на основе законов Рауля и Вант-Гоффа теоретические величины совпадают с найденными опытным путем только для разбавленных растворов неэлектролитов. Иначе ведут себя растворы электролитов. Эти растворы показывают всегда более сильное пони - жение давления пара, более сильное понижение температуры замерзания и более высокое осмотическое давление по ера-внению с теоретически найденными величинами. В этом про-является отступление растворов электролитов от законов Рауля и Вант-Гоффа. [23]
Зная массу последнего и по какому-либо свойству - понижению давления пара растворителя, понижению температуры замерзания или повышению температуры кипения раствора, осмотическому давлению - его количество, можно вычислить среднюю молярную массу ( следовательно, и молекулярную) растворенного вещества, что довольно часто используется при изучении новых веществ, в частности полимеров. [24]
Набухание геля, таким образом, может быть описано с помощью понижения давления пара растворителя, независимо от того, какие факторы обусловливают это понижение давления пара. При расчетах с помощью уравнения ( 2) возникает некоторая неопределенность в, принимаемом значении парциального молярного объема V. При прибавлении воды к сухому белку всегда происходит сжатие объема. Сумма объемов воды и белка, взятых отдельно, будет всегда больше, чем объем их обоих в смешанном виде. [25]
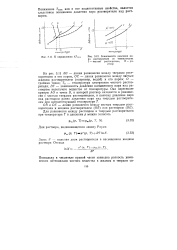 |
Зависимости давления па. [26] |
Понижение Гзам, как и все коллигативные свойства, является следствием понижения давления пара растворителя над раствором. [27]
Выпадение из раствора даже ничтожно малого количества кристаллов растворителя приводит к увеличению концентрации растворенного вещества, понижению давления пара растворителя над раствором и соответственно к понижению температуры плавления следующих порций кристаллов растворителя. [29]
Pt - давление пара растворителя над раствором данной концентрации; ДР / Р, - относит ельноэ понижение давления пара растворителя; пг - число молей растворенного вещества; п - число молей растворителя. [30]
Страницы: 1 2 3 4