Потенциал - металл
Cтраница 1
Потенциал металла в щели сдвигается в сторону более отрицат. В), в к-ром металл в щеля - растворяющийся анод, металл на открытой пов-сти - катод. [1]
Потенциалы металлов в нулевых растворах по отношению к стандартному электроду, так называемые потенциалы нулевого заряда или нулевые точки металлов по Фрумкину, могут быть измерены разными методами, которые основываются на наблюдении за зависимостью адсорбционных явлений от заряда поверхности. [2]
 |
Схема правильно разомкнутой цепи с двумя металлами в нулевых точках. [3] |
Потенциалы металлов в нулевых растворах по отношению к стандартному электроду, так называемые потенциалы нулевого заряда, или нулевые точки металлов, по Фрумкину, могут быть измерены разными методами, которые основаны на наблюдении за зависимостью адсорбционных явлений от заряда поверхности. [4]
 |
Насыщенный каломельный электрод сравнения. [5] |
Потенциалы металлов, находящихся в равновесии с собственными ионами в растворе, называются равновесными или обратимыми, так как эти электроды обратимо обменивают катионы с раствором. [6]
Потенциал металла по отношению к точкам земли, расположенным на некотором небольшом расстоянии от подземного сооружения, численно равен электрохимическому потенциалу и падению напряжения на изоляционном слое и в слое земли от поверхности изоляции до рассматриваемой точки. [7]
Потенциалы металлов в растворах их солей также могут рассматриваться как потенциалы окислительно-восстановительных реакций. [8]
Потенциалы металлов в промышленных электролитах, в растворах простых и комплексных солей обычно сильно отличаются от равновесных. Их надо экспериментально определять для отдельных случаев. Сдвиги равновесных потенциалов могут быть достигаемы изменением активности ионов в электролите. [9]
Потенциал металла, входящего в состав электрода, но отношению к расплаву зависит от состояния, в котором металл находится. Если металлы не образуют твердых растворов и химических соединений, то растворяться прежде всего будет наиболее электроотрицательный из них. Если два металла образуют твердые растворы, то потенциал электрода меняется в соответствии с концентрациями элементов. Крайние значения соответствуют потенциалам чистых металлов. [10]
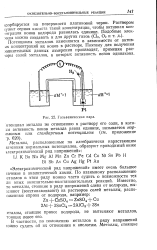 |
Гальваническая пара. [11] |
Потенциалы металлов изменяются в зависимости от актив - jx концентраций их ионов в растворе. Поэтому для получения авнитедьных данных измерения производят, применяя рас-юры солей металлов, в которых активность ионов одинакова. [12]
Потенциалы металлов в воде, конечно, отличны от их потенциалов в стандартных условиях; в большинстве случаев они имеют более отрицательное значение. Но, как правило, это не сказывается на правильности выводов о способности металлов вытеснять водород из воды. [13]
Потенциалы металлов в воде, конечно, отличны от их потенциалов з стандартных условиях; в большинстве случаев они имеют более отрицательное значение. Но, как правило, это не сказывается на правильности выводов о способности металлов вытеснять водород из воды. [14]
Потенциалы металлов в воде, конечно, отличны от их потенциалов в стандартных условиях; в большинстве случаев они имеют более отрицательное значение. Но, как правило, это не сказывается на правильности выводов о способности металлов вытеснять водород из воды. [15]
Страницы: 1 2 3 4