Потенциал - металл
Cтраница 3
Потенциалы металлов, при погружении которых в электролит в переносе зарядов через границу металл-электролит участвуют не только ионы соответствующего металла, но и другие ионы и молекулы, называются неравновесными или необратимыми потенциалами. При этом наблюдается баланс по электрическим зарядам, но нет баланса по массе. Происходит растворение или коррозия металла. [31]
 |
Насыщенный каломельный электрод сравнения. [32] |
Потенциалы металлов, находящихся в равновесии с собственными ионами в растворе, называются равновесными или обратимыми, так как эти электроды обратимо обменивают катионы с раствором. [33]
 |
Процесс электрохимической коррозии в грунте. [34] |
Потенциал металла по отношению к грунту зависит не только от его физико-химических свойств, но и от свойств грунта. Вследствие неоднородности грунта также возникают гальванические пары. Физико-химическая неоднородность близко расположенных участков металла приводит к образованию микротар. [35]
 |
Процесс электрохимической коррозии. [36] |
Потенциал металла по отношению к грунту зависит не только от его физико-химических свойств, но и от свойств грунта. Вследствие неоднородности грунта также возникают гальванические пары. Физико-химическая неоднородность близко расположенных участков металла приводит к образованию микропар. [37]
 |
Схема двойного электрического слоя ( плоская модель. [38] |
Потенциал металла в нулевом растворе Нернст определяет как абсолютный нуль потенциалов. [39]
Потенциалы металлов в воде, конечно, отличны от их потенциалов в стандартных условиях; в большинстве случаев они имеют более отрицательное значение. Но, как правило, это не сказывается на правильности выводов о способности металлов вытеснять водород из воды. [40]
Потенциал металла сложным образом зависит от концентрации иона в растворе. [41]
Потенциал металла в щели сдвигается в сторону более отрицат. В), в к-ром металл в щели - растворяющийся анол, металл на открытой пов-сти - катод. [42]
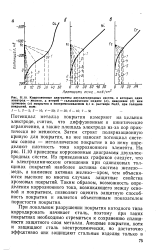
Потенциал металла покрытия измеряют на цельном электроде, считая, что диффузионные и кинетические ограничения, а также площадь электрода из-за пор практически не меняются. Затем строят поляризационную кривую для покрытия, на нее наносят потенциал системы основа - металлическое покрытие и по нему определяют плотность тока коррозионного элемента. На рис. 11.10 приведены коррозионные диаграммы двухэлектродных систем. Из приведенных графиков следует, что в электрохимическом отношении при одинаковых толщинах покрытий наиболее активна система железо - медь, а наименее активна железо-хром, чем объясняются высокие во многих случаях защитные свойства хромовых покрытий. Таким образом, возможность определения коррозионного тока, возникающего между основой и покрытием, позволяет оценить защитную способность покрытия и является объективным показателем пористости покрытия. [44]
Страницы: 1 2 3 4