Потенциал - питтингообразование
Cтраница 1
Потенциал питтингообразования ( - ЕПо) характеризует нарушение пассивного состояния. Он является наименьшим потенциалом, при достижении которого начинается стабильный рост образования пит-тингов. Епо - Екор служит характеристикой склонности металла к питтинговой коррозии и влияния внешних параметров. Этот показатель и определяют при постановке исследований по данной методике. [1]
Потенциал питтингообразования его в растворах с С1 - имеет значение 12 в. При увеличении концентрации воды титан переходит IB устойчивое пассивное состояние. [2]
Потенциалы питтингообразования определяют различными методами. При определении фпо необходимо учитывать скорость наложения потенциала. Для получения более точных данных необходимо использовать потенциостатический метод. [3]
Потенциал питтингообразования Епо характеризует нарушение пассивного состояния. Он является наименьшим потенциалом, при достижении которого начинается стабильный процесс образования питтингов. [4]
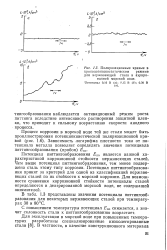 |
Поляризационные кривые в хронопотенциостатическом режиме для нержавеющей стали в аэрированной морской воде. [5] |
Потенциал питтингообразования Еао является важной характеристикой коррозионной стойкости нержавеющих сталей. Чем выше потенциал питтингообразования, тем менее подвержена сталь этому типу коррозии. Потенциал питтингообразования принят за критерий для одной из классификаций нержавеющих сталей по их стойкости к морской коррозии. Для возможности сравнения коррозионной стойкости потенциалы сталей определяются в деаэрированной морской воде, не содержащей окислителей. [6]
Потенциал питтингообразования Епо характеризует нарушение пассивного состояния. Он является наименьшим потенциалом, при достижении которого начинается стабильный процесс образования питтингов. [7]
Потенциалу питтингообразования на кривой заряжения соответствует то максимальное положительное значение, которое приобретает электрод при критической плотности тока. [8]
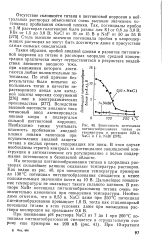 |
Зависимость потенциала питтингообразования титана от температуры в растворах 0 53 н. NaCl и 1 н. NaBr. [9] |
На потенциал питтингообразования титана в хлоридных растворах сильнейшее влияние оказывает температура растворов. Как видно из рис. 40, при повышении температуры примерно до 130 С потенциал питтингообразования смещается к менее положительным значениям почти на 10 В. Дальнейшее повышение температуры не оказывает такого сильного влияния. В растворе NaBr потенциал питтингообразования титана очень незначительно изменяется при повышении температуры. NaCl даже при 250 С потенциал питтингообразования превышает 1 0 В, тогда как стационарный потенциал титана в этих условиях даже при насыщении раствора кислородом не превышает 0 6 В. [10]
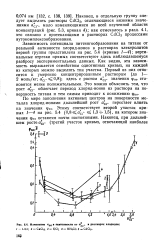 |
Изменение Рпо зависимости от а в растворах хлоридов. [11] |
Зависимость потенциала питтингообразования на титане от реальной активности хлорид-ионов в растворах электролитов первой группы представлена на рис. 5.4 ( кривые / - 4); вертикальные отрезки прямых соответствуют здесь наблюдавшемуся разбросу экспериментальных данных. Как видно, эта зависимость выражается семейством однотипных кривых, на каждой из которых можно выделить три участка. Первый из них относится к умеренно концентрированным растворам ( до 1 - 2 моль / кг; асг 0 8); здесь с ростом а сг значения pno становятся менее положительными. Это можно объяснить тем, что рост UCP облегчает переход хлорид-ионов из раствора на поверхность титана и тем самым приводит к понижению фпо. [12]
Понижение потенциала питтингообразования указывает на снижение коррозионной стойкости металла. Наоборот, увеличение потенциала питтингообразования связано с возрастанием буферной емкости и скорости движения воды. [13]
Значения потенциала питтингообразования, составляющие 0 38 В в Ш растворе НС1 и 0 45 В 0 1М растворе NaCl [47], указывают на склонность металла к питтингу в морской воде. Такое поведение циркония, подобное поведению технического титана, указывает, что наличие напряжений не является обязательным условием для возникновения трещин, и разрушения, возможно, лучше объясняются межкристаллитной коррозией. [14]
ЧРпо - потенциалы питтингообразования при УФ-освещении и без него), в растворе Nad активирует металл, инициируя образование питтингов, тогда как в растворе Na2SO4 отмечается лишь сравнительно небольшой рост анодного тока в период освещения ( рис. XI. Одно из возможных объяснений заключается в том, что под действием УФ-освещения скачок потенциала уменьшается в полупроводниковом поверхностном окисле и соответственно возрастает ( поскольку ф const) на границе окисел - раствор; возможно, этот скачок и играет основную роль в процессе депассивации стали. [15]
Страницы: 1 2 3 4