Потенциал - питтингообразование
Cтраница 3
Молибден вызывает смещение потенциала пробоя пассивной пленки или потенциала питтингообразования ( точка г) в положительную сторону, что будет соответствовать повышению стойкости к питтинговой коррозии. [31]
Подавление питтингообразования в хлорид-нитратных растворах при потенциалах, превышающих верхний потенциал питтингообразования, названный Феттером [29] потенциалом ингиби-рования питтинговой коррозии ф н, наблюдалось Браунсом и Швенком [33] на нержавеющих сталях. [32]
Как указывалось выше, точечная коррозия происходит при достижении потенциала питтингообразования. При катодной поляризации потенциал металла смещается в отрицательную сторону, в результате чего адсорбция анионов-активаторов затрудняется. При потенциале металла несколько отрицательнее потенциала питтингообразования точечная коррозия не происходит. [33]
 |
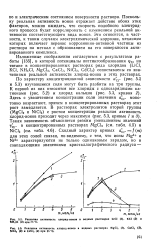
Анодная поляризация при постоянном потенциале 0 74 в. [34] |
При 0 5 - н концентрации НС1 при достижении потенциала питтингообразования наблюдается резкое увеличение тока. Точки ai, а2 соответствуют начальному моменту образования питтинга, участок a bi или а2Ь2 относится к расширению площади питтинга на весь торец образца. После точки Ъ или Ь2 вся поверхность образца работает как питтинг. [35]
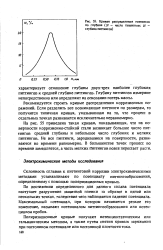 |
Кривая распределения пипингов по глубине ( N - число пипингов. Я - глубина питтингов. [36] |
Склонность сплавов к питтинговой коррозии электрохимическими методами устанавливают по потенциалу питтингообразования, определенному с помощью поляризационных кривых. [37]
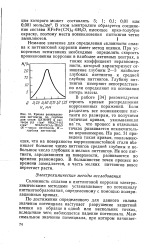 |
Кривая распределе - ТИНГИ ПО размерам, ТО ПОЛУЧИТСЯ. [38] |
Склонность сплавов к питтинговой коррозии электро-химическими методами устанавливают по потенциалу питтингообразования, определенному с помощью поляризационных кривых. [39]
Защита осуществляется смещением потенциала до более положительных значений, чем потенциал питтингообразования; так как развитие питтинга требует некоторого времени, быстрый переход такой области не связан с разрушением металла. [40]
Изложенные соображения согласуются с результатами работы [135], в которой потенциалы питтингообразования фпо на титане в концентрированных растворах ряда хлоридов ( LiCl, КС1, NH4C1, MgCh, СаСЬ, NiCb, CdCh) сопоставлены со значениями реальной активности хлорид-ионов в этих растворах. [42]
Зарождение питтинга в слабых местах пассивной пленки при достижении определенного потенциала ( потенциала питтингообразования) за счет окислителя или анодной поляризации в присутствии активирующих ионов в растворе, которые вытесняют адсорбированный кислород или, взаимодействуя с ним, разрушают пленку. Местное ослабление пассивности может быть обусловлено неоднородностью структуры металла ( интерметаллические и другие включения), случайными механическими повреждениями в защитной пленке и другими причинами. [43]
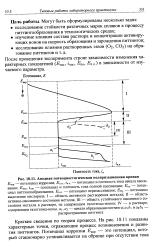 |
Анодная потенциостатнческая поляризационная кривая. [44] |
Епас, пас - потенциал и плотность тока полной пассивации; Ет - потенциал питтингообразования; Е, , - потенциал перепассивации; Ео2 - потенциал выделения кислорода. I - область активного растворения металла; II - область активно-пассивного состояния металла; III - область устойчивого пассивного состояния металла в растворе, не содержащем галогенид-ионов; IV - в растворе, содержащем галогенид-ионы. [45]
Страницы: 1 2 3 4