Потенциал - полуволна - восстановление
Cтраница 2
У коричного альдегида и его з-амещенных потенциал полуволны восстановления менее отрицателен, чем у бензальдегида и его производных. [16]
В таком же порядке изменяются и потенциалы полуволны восстановления катионов-акцепторов в водной среде. Для специфических комплексов данного донора ( иона 1 -), по-видимому, должно существовать простое соотношение между энергией, переноса заряда и сродством акцептора к электрону. [17]
 |
Потенциалы полуволн восстановления комплексных соединений никеля. [18] |
Следует иметь в виду, что потенциалы полуволн восстановления комплексных ионов металлов отличаются от потенциалов полуволн простых ионов и зависят от констант устойчивости комплекса. [19]
На ряде примеров было проведено сравнение потенциалов полуволн восстановления ацетиленовых комплексов со значениями Et /, для свободных лигандов. [20]
Каждый из этих комплексов был охарактеризован потенциалом полуволны восстановления, потенциалами катодных и анодных пиков на циклических вольтамперограммах, числом электронов, переходящих в начальной стадии и долей комплекса, возвращаемого без изменения при препаративном восстановлении или окислении. В табл. 13.7 приведены полярографические потенциалы полуволны и число перенесенных электронов п, найденное кулонометрией. [21]
Из приведенных уравнений видно, что величины потенциалов полуволн восстановления нитробензола должны сильно зависеть от концентрации водородных ионов, так как они участвуют в реакциях восстановления. В буферных растворах при рН 2 первая волна восстановления наблюдается при потенциале - 0 15 в, в нейтральных растворах ( рН 7) - при - 0 47 в, а в щелочных растворах - при - 0 63 в. [22]
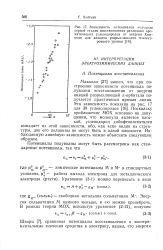 |
Зависимость потенциалов полуволн первой стадии восстановления различных ароматических углеводородов от энергии Хюк-келя для низшего разрыхляющего я-элект-ронного уровня. [23] |
Макколл [27] нашел, что при построении зависимости потенциала полуволны восстановления от энергии низшей разрыхляющей я-орбитали получается практически прямая линия. [24]
При переходе от водных растворов к растворам в органических растворителях потенциалы полуволн восстановления радикалов 2, 4, 8, 9 сдвигаются в область более отрицательных значений по мере ослабления протогенного характера растворителя в ряду: вода - 20 % - й этанол - этанол - бензол метанол ( 1: 1) - диметилфор-мамид. Влияние фонового электролита, а также природы заместителей в положении 4 пиперидинового цикла на электрохимическое восстановление нитроксильных радикалов Выражено значительно слабее, чем влияние растворителя. [25]
Формальные потенциалы этих систем обычно определяют поля-рографически, причем отыскивают потенциал полуволны восстановления феррицений ( кобальтицений) - катиона в разбавленном растворе, поскольку растворимость незаряженных восстановленных форм в полярных растворителях часто мала. [26]
Уравнение (25.12) показывает, что, как уже было указано, потенциал полуволны восстановления ионов М не зависит от концентрации этих ионов и есть величина постоянная. [27]
В отдельных растворителях наблюдается большее по сравнению с водой расстояние между потенциалами полуволн восстановления ионов щелочноземельных металлов [1153, 1197], что может быть использовано для их аналитического определения и разделения. [28]
Как и для ионов щелочных металлов, с увеличением сольвати-рующей способности растворителя потенциалы полуволн восстановления щелочноземельных металлов сдвигаются в отрицательную сторону. Прослеживается качественная тенденция сдвига Е / 2 с увеличением донорного числа растворителя в отрицательную сторону. [29]
Как и для ионов щелочных металлов, с увеличением сольвати-рующей способности растворителя потенциалы полуволн восстановления щелочноземельных металлов сдвигаются в отрицательную сторону. [30]
Страницы: 1 2 3 4