Потенциал - полунейтрализация
Cтраница 2
Значения потенциалов полунейтрализации кислот и оснований зависят от многих факторов, поэтому определение относительной шкалы кислотности каждого растворителя проводилось с одной и той же системой титрантов: хлорная кислота - гидроокись тетразтиламмония и одной и той же системой электродов: стеклянный - насыщенный каломельный. [16]
Абсолютные значения потенциалов полунейтрализации в неводных растворах нестабильны, поэтому измеряют потенциалы полунейтрализации по отношению к потенциалу полунейтрализации стандартного вещества. Часто в качестве стандарта при определении потенциалов полунейтрализации кислот используют бензойную кислоту, а при определении потенциалов полунейтрализации оснований - дифенилгуанидин. [17]
Таким образом, потенциалы полунейтрализации и ОШК, получаемые на их основе, являются непостоянными; их значения изменяются в широких пределах в зависимости от условий определения. Курьезность заключается в том, что предсказать возможность оттитровать то или иное соединение или смесь веществ в том или ином растворителе по потенциалам полунейтрализации практически нельзя; экспериментатору приходится проводить серию опытов, чтобы удостовериться в возможности успешного использования избранного растворителя для данного случая титрования. [19]
Чаттен [137] сравнил потенциалы полунейтрализации феноти-азинов и основных аминов ( типа эфедрина) в пяти органических растворителях: ацетоне, ацетонитриле, ледяной уксусной кислоте, изопропиловом спирте и нитрометане с их р / ( в ( Н2О) и установил в свою очередь, что основания со сходной структурой имеют общую линейную зависимость между р / С ( Ir O) и A. Автор установил также, что природа растворителя, наряду со структурой основания, играет значительную роль. Например, в среде уксусной кислоты получена общая линейная зависимость для всех оснований, а в среде ацетона, ацетонитрила и нитрометана, обладающих хорошими дифференцирующими свойствами, для каждой группы оснований получена своя зависимость. Изопропиловый спирт оказывает нивелирующее действие на амины. [20]
Чаттен [137] сравнил потенциалы полунейтрализации феноти-азинов и основных аминов ( типа эфедрина) в пяти органических растворителях: ацетоне, ацетонитриле, ледяной уксусной кислоте, изопропиловом спирте и нитрометане с их р / ( в ( Н20) и установил в свою очередь, что основания со сходной структурой имеют общую линейную зависимость между рК ( Н20) и A. Автор установил также, что природа растворителя, наряду со структурой основания, играет значительную роль. Например, в среде уксусной кислоты получена общая линейная зависимость для всех оснований, а в среде ацетона, ацетонитрила и нитрометана, обладающих хорошими дифференцирующими свойствами, для каждой группы оснований получена своя зависимость. Изопропиловый спирт оказывает нивелирующее действие на амины. [21]
Для смесей разность потенциалов полунейтрализации 200 - 300 мВ в большинстве случаев оказывается достаточной для осуществления избирательного титрования в подходящем интервале концентраций. [22]
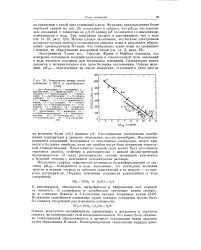 |
Зависимость между силой. [23] |
Построение графика зависимости потенциала полунейтрализации от значения рКвн, измеренного в воде, показывает, что последняя величина зависит в первую очередь от действия заместителей и во вторую - от природы растворителя. [24]
 |
Влияние диэлектрической проницаемости растворителей на потенциал полунейтрализации ( ППН. [25] |
При потенциометрическом титровании кислот потенциал полунейтрализации ( ППН) примерно пропорционален константе ионизации кислот. Соотношение между ППН, сольватирующей способностью растворителя и диэлектрической проницаемостью ( е) не является однозначным. На рис. 5 графически изображено изменение потенциала полунейтрализации иона шшеридиния, уксусной кислоты и бисульфат-аниона как функции величины 1 / е: влияние диэлектрической проницаемости растворителя является наименьшим в случае катионных кислот. [26]
Фритц [131] сравнил значения потенциалов полунейтрализации аминов в ацетонитриле со значениями их р / Св ( Н2О) и первый пришел к выводу, что потенциалы полунейтрализованных растворов находятся в прямой зависимости от силы аминов. [27]
Фритц [131] сравнил значения потенциалов полунейтрализации аминов в ацетонитриле со значениями их р / Св ( Н20) и первый пришел к выводу, что потенциалы полунейтрализованных растворов находятся в прямой зависимости от силы аминов. [28]
 |
Дифференциальная кривая титрования кодеина с использованием нитрометана в качестве растворителя. [29] |
Между значением рКлк оснований и потенциалом полунейтрализации ( ППН) существует линейная зависимость ( гл. Титрование проводят потенциометрически в нитрометане со стеклянным и каломельным электродами. [30]
Страницы: 1 2 3 4
