Потенциал - полунейтрализация
Cтраница 3
В реальных условиях титрования при определении потенциалов полунейтрализации указанным методом вместе с титрантами в титруемый раствор, как правило, неизбежно вводятся посторонние растворители ( обычно уксусная кислота с НС1О4 и метиловый или этиловый спирт и бензол с R4NOH, в которых растворены реагенты), осложняющие условия титрования и изменяющие эмпирическую шкалу кислотности избранного растворителя, так как титрование в этом случае ведется не в среде чистого растворителя. В результате сказывается отрицательное влияние примесей на процесс кисло-тао-основного титрования и данные получаются неточные. [31]
В реальных условиях титрования при определении потенциалов полунейтрализации указанным методом вместе с титрантами в титруемый раствор, как правило, неизбежно вводятся посторонние растворители ( обычно уксусная кислота с НСЮ4 и метанол или этанол и бензол с R4NOH, в которых растворены реагенты), осложняющие условия титрования и изменяющие эмпирическую шкалу кислотности избранного растворителя. В результате данные получаются неточные. [32]
В реальных условиях титрования при определении потенциалов полунейтрализации указанным методом вместе с титрантами в титруемый раствор, как правило, неизбежно вводятся посторонние растворители ( обычно уксусная кислота с НСЮ4 и метиловый или этиловый спирт и бензол с R4NOH, в которых растворены реагенты), осложняющие условия титрования и изменяющие эмпирическую шкалу кислотности избранного растворителя, так как титрование в этом случае ведется не в среде чистого растворителя. В результате сказывается отрицательное влияние примесей на процесс кислотно-основного титрования и данные получаются не точные. [33]
Стрейли показал, что зависимость между потенциалами полунейтрализации в уксусном ангидриде и р / С ( Н2О) разная для нейтральных и анионных оснований. Анионы по сравнению с нейтральными соединениями проявляют себя более сильными основаниями в уксусном ангидриде, чем в воде, вследствие чего возможно их дифференцированное определение в этом растворителе. [34]
При этом скачок потенциала между так называемым потенциалом полунейтрализации ( перегиб кривой титрования) и потенциалом, находящимся на расположенном выше горизонталь - ном участке кривой, служит мерой шкалы потенциалов дан-ного растворителя и оценивается с помощью системы. [35]
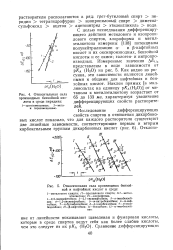
Крешковым и другими [ 114 были измерены потенциалы полунейтрализации фенола и его производных в среде метилового, этилового, пропилового, изопропилового, бутилового и изобути-лового спиртов. По дифференцирующему действию они располагаются в следующем убывающем порядке: изопропиловый, изобутиловый, пропиловый, этиловый, метиловый. [36]
Стрейли [133] показал, что зависимость между потенциалами полунейтрализации в уксусном ангидриде и р / СА ( Н2О) разная для нейтральных и анионных оснований. Анионы более сильные основания в уксусном ангидриде, чем в воде, по сравнению с нейтральными соединениями, вследствие чего возможно их дифференцированное определение в этом растворителе. Исследования [134] условий титрования в среде нитрометана первичных, вторичных и третичных аминов, гетероциклических оснований, мочевины, амидов, производных гуанидина и имидатов показало, что линейная зависимость между потенциалами полунейтрализации и величинами Р / ( А ( Н20) наблюдается лишь для аминов и для амидов, а гетероциклические основания этой зависимости не подчиняются. [37]
Стрейли [133] показал, что зависимость между потенциалами полунейтрализации в уксусном ангидриде и р / ( А ( Н20) разная для нейтральных и анионных оснований. Анионы более сильные основания в уксусном ангидриде, чем в воде, по сравнению с нейтральными соединениями, вследствие чего возможно их дифференцированное определение в этом растворителе. Исследования [134] условий титрования в среде нитрометана первичных, вторичных и третичных аминов, гетероциклических оснований, мочевины, амидов, производных гуанидина и имидатов показало, что линейная зависимость между потенциалами полунейтрализации и величинами р / Сл ( НгО) наблюдается лишь для аминов и для амидов, а гетероциклические основания этой зависимости не подчиняются. [38]
Измерения кислотности в этой среде сравнивали с потенциалом полунейтрализации ( ППН) бензойной кислоты, условно принятым за нуль. Этот прием обычно используют для устранения ежедневных колебаний диффузионных потенциалов. [39]
Стреули, Фрица и Вейбела показали, что измерение потенциала полунейтрализации и относительной силы оснований в воде является полезным при титровании оснований. Сольватация может привести к незначительным или даже большим отклонениям. [40]
Абсолютные значения потенциалов полунейтрализации в неводных растворах нестабильны, поэтому измеряют потенциалы полунейтрализации по отношению к потенциалу полунейтрализации стандартного вещества. Часто в качестве стандарта при определении потенциалов полунейтрализации кислот используют бензойную кислоту, а при определении потенциалов полунейтрализации оснований - дифенилгуанидин. [41]
 |
Прибор для потенциометрического титрования в инертных растворителях. [42] |
Для точных измерений необходимо, чтобы разность между потенциалом точки эквивалентности и потенциалом полунейтрализации ( потенциал в точке, в которой израсходована половина раствора) составляла 200 - 300 мв / мл. [43]
Поскольку уравнение (10.8) является приближенным, то и определение эмпирической шкалы кислотности по потенциалам полунейтрализации носит тоже приближенный характер. [44]
 |
Относительная сила производных бензойной кислоты в среде пиридина.| Относительная сила производных бензойной и нафтойных кислот в среде. [45] |
Страницы: 1 2 3 4