Потенциал - полунейтрализация
Cтраница 4
С целью исследования дифференцирующего действия метилового и изопропи-лового спиртов, хлороформа и метил-этилкетона измерены [138] потенциалы полунейтрализации а - и р-нафтойных кислот и их оксипроизводных, бензойной кислоты и ее окиси; галоген - и нитропро-изводных. Как видно из рисунка, эти зависимости являются линейными и общими для нафтойных и бензойных кислот. Наклон прямых [ в милливольтах на единицу р / СА ( Н20) ] от метанола к метилэтилкетону возрастает от 65 до 133 мв, характеризуя увеличение дифференцирующих свойств растворителей. [46]
Поскольку уравнение ( 37) является приближенным, то и определение эмпирической шкалы кислотности по потенциалам полунейтрализации носит тоже приближенный характер. [47]
Потенциометрическое титрование в среде уксусного ангидрида основывается на линейной зависимости между значением рКцк оснований и потенциалом полунейтрализации [778] ( гл. [48]
Строгими характеристиками титруемых электролитов являются также термодинамические константы их диссоциации, значения которых в отличие от потенциалов полунейтрализации не изменяются. Сопоставление АШК с константами диссоциации электролитов позволяет предвидеть возможность дифференцированного титрования смесей электролитов, так как в среде дифференцирующих растворителей наблюдается резкое различие в силе электролитов. [49]
Абсолютные значения потенциалов полунейтрализации в неводных растворах нестабильны, поэтому измеряют потенциалы полунейтрализации по отношению к потенциалу полунейтрализации стандартного вещества. Часто в качестве стандарта при определении потенциалов полунейтрализации кислот используют бензойную кислоту, а при определении потенциалов полунейтрализации оснований - дифенилгуанидин. [50]
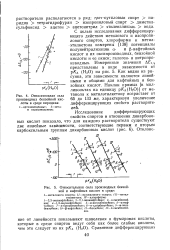 |
Относительная сила производных бензойной кис - 65 до 133 мв, характеризуя увеличение.| Относительная сила производных бензойной и нафтойных кислот в среде. [51] |
С целью исследования дифференцирующего действия метилового и изопропи-лового спиртов, хлороформа и метил - - этилкетона измерены [138] потенциалы полунейтрализации а - и р-нафтойных кислот и их оксипроизводных, бензойной кислоты и ее окиси; галоген - и нитропро-изводных. Как видно из рисунка, эти зависимости являются линейными и общими для нафтойных и бензойных кислот. [52]
Простым, удобным и быстрым методом оценки влияния растворителей на силу кислот и оснований является метод определения относительной кислотности электролитов по потенциалам полунейтрализации. В момент, когда нейтрализовано 50 % определяемой слабой кислоты или слабого основания, рН рК - Следовательно, величина потенциала полунейтрализации определяется величиной / Сдисс титруемого электролита и может характеризовать его относительную силу в неводных растворах. [53]
Простым, удобным и быстрым методом оценки влияния растворителей на силу кислот и оснований является метод определения относительной кислотности электролитов по потенциалам полунейтрализации. В момент, когда нейтрализовано 50 % определяемой слабой кислоты или слабого основания, рН р / С. Следовательно, величина потенциала полунейтрализации определяется величиной Ддисг. [54]
Стреули [199] выявил в процессе титрования незаряженных и анионных оснований линейную зависимость, существующую между значениями р / СдСНгО) и потенциалами полунейтрализации оснований в УА. Эта зависимость для незаряженных и анионных оснований различна, поскольку анионы являются более сильными основаниями в ( СНзСО О, чем в Н2О, по сравнению с незаряженными соединениями. [55]
Дифференцирующее действие растворителей в отношении данной группы электролитов характеризуется наклоном прямой к оси абсцисс: чем круче идет прямая, тем больше различаются потенциалы полунейтрализации электролитов и тем больше возможность раздельного определения их в смеси. [56]
Страницы: 1 2 3 4