Потенциал - разряд
Cтраница 3
Напряжение разложения и потенциал разряда ионов в расплавах измеряются обычно с применением платиновых веплати-нированных электродов. [31]
Очевидно, что потенциал разряда иона СГ - из нормального раствора хлористоводородной кислоты ниже, чем потенциал разряда иона ОН -, вследствие этого электролиза воды не происходит. Ион хлора разряжается при более высоком потенциале, и напряжение разложения разбавленной кислоты на хлор и водород должно было бы быть выше 1 69 в, а поэтому, как только напряжение достигает этой величины, происходит выделение на аноде кислорода. [32]
 |
Распределение энергии нием ( 3 в коротковолновой области ( области высокой частоты резкую границу. Эта граница, а вместе с ней и максимум интенсивности, как это непосредственно. [33] |
Если, постепенно повышая потенциал разряда, смещать границу все более в область высоких частот, то в некоторый вполне определенный момент ( в зависимости от материала антикатода) наблюдается появление чрезвычайно сильного излучения. [34]
 |
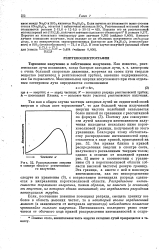
Типичная поляризационная кривая. [35] |
Совершенно аналогично можно определить потенциал разряда или потенциал выделения кислорода. Кислород, выделившийся на аноде, также создает потенциал поляризации, возрастающий с накоплением ( увеличением давления) кислорода. При выделении металлов, например, при выделении цинка на катоде, сделанном из какого-либо инертного металла, также необходимо применить такой потенциал, при котором можно было бы преодолеть энергию растворения металла. [36]
В табл. 21.2. приведены потенциалы разряда ионов и уравнения первичных процессов при электролизе с железным катодом. [37]
Облагораживающее действие ртути на потенциал разряда ионов металлов позволяет осаждать из растворов амальгамной цементацией металлы, находящиеся в ряду напряжений левее водорода, со значительным выходом по току, или иначе, при небольшом избытке металла-цемента-тора. Это явление связано с изменением соотношения токов разряда ионов водорода и металла в пользу последних. При этом следует учитывать и то обстоятельство, что перенапряжение выделения водорода на ртути довольно велико. [38]
 |
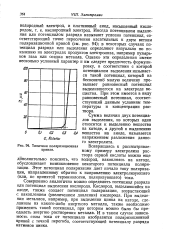
Влияние кислотности ( 2.| Потенциалы выделения хлора ( / и кислорода ( 2 из 23 % - ного раствора NaCl при 50 С ( сплошные линии - платиновый анод, пунктирные - графитовый. [39] |
При малых плотностях тока потенциалы разряда ионов хлора и гидроксила близки друг другу и соответственно доля тока, расходуемая на выделение кислорода, существенно возрастает. [40]
 |
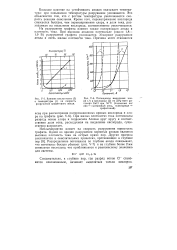
Схема электролизной ваниы для получения алюминия. [41] |
В соответствии с величинами потенциалов разряда в процессе электролиза крио-лито-глиноземного расплава по упрощенной схеме на электродах разряжаются ионы А13 и О2 -, образующиеся при электролитической диссоциации растворенного в электролите глинозема. [42]
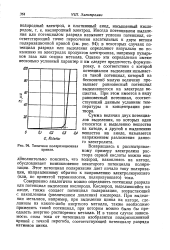 |
Типичная поляризационная кривая. [43] |
Иногда потенциалом выделения или потенциалом разряда называют условно потенциал, соответствующий точке пересечения касательных к двум ветвям поляризационной кривой ( см. рис. 94); в некоторых случаях потенциал разряда или выделения определяют визуально по появлению на электродах продуктов электролиза, например пузырьков газа или осадка металла. Однако эти определения имеют несколько условный характер и им следует предпочесть формулировку, в соответствии с которой потенциалом выделения называется такой потенциал, который на бесконечно малую величину превышает равновесный потенциал выделившегося на электроде вещества. При этом имеется в виду равновесный потенциал, соответствующий данным условиям температуры и концентрации раствора. [44]
Сопоставление полученных данных о потенциалах разряда ионов кобальта с потенциалами разряда ионов никеля в соответствующих растворах показывает, что кобальт осаждается при менее электроотрицательных потенциалах, чем никель, и разряд ионов кобальта протекает при неизменной величине поляризации с большей скоростью, чем разряд ионов никеля. [45]
Страницы: 1 2 3 4