Потенциал - система
Cтраница 2
Потенциал системы II, определенный из кривых титрования всех тиосульфатных комплексов, выделенных из насыщенных растворов тиосульфата натрия и сульфата меди одинаков и равняется 0.455 V. Потенциал той же системы, определенный из кривой титрования соответствующей смеси разбавленных растворов, на 0.029 V выше указанного. [16]
Потенциал системы относительно стандартного насыщенного каломельного электрода ( НКЭ) равен 0 4 В. Энзимный электрод состоит из следующих элементов: чувствительное устройство ( Pt-электрод), пленка, где происходит ферментативная реакция ( глкжозооксидаза, фиксированная в пористом или гелевом слое) и диализная целлофановая мембрана. При измерении глюкозы в крови в последнюю необходимо добавлять буферный раствор ( 0 04 М раствор фосфата с рН 7 4, содержащий 0 026 М NaCl 0 004 М КС1) и хинон. При подаче на электрод напряжения 0 4 В получают ток, пропорциональный концентрации глюкозы. В параллельном опыте с электродом подобного типа, но без энзима измеряют холостой, или фоновый ток, значение которого вычитают из значений, полученных с энзимным электродом. [17]
Слабый мотивационный потенциал систем оплаты труда энергопредприятий подтверждается увеличением в 90 - е годы численности персонала в электроэнергетике страны в 1 5 раза, причем в условиях постоянства объемов производственных мощностей и примерно 30 % - го снижения их загрузки. Конечно, менеджеры энергопредприятий приводят различные причины, оправдывающие эти факты. [18]
Если потенциал системы в сосуде А поддерживается при помощи электрода сравнения, то вольтметр фиксирует любое изменение потенциала системы в сосуде В. Такой принцип измерения лежит в основе метода потенциометрического титрования. [19]
О-в потенциал системы НАД / НАД-Н2 ( см. табл. 13) составляет при рН 7 - 0 32 в. Разность потенциалов между этой системой и системой / 2 О2 / О - ( о-в 0 81) составляет 1 13 в. Такому потенциалу соответствует изменение свободной энергии ДС - 52 ккал / моль нуклеотида. Это то количество энергии, которое можно теоретически получить при окислении 1 моль водорода, находящегося в окисляющемся биологическом субстрате. [20]
Теперь потенциал системы AsOl / AsOs стал меньше, чем потенциал системы J2 / 2J -, и, таким образом, йод может окислять трехвалентный мышьяк до пятивалентного. Поэтому в нейтральной ( или в слабощелочной) среде мышьяковистую кислоту и ее соли можно титровать раствором йода. [21]
Теперь потенциал системы AsO / AsOg стал меньше, чем потенциал системы Ь / 21, и, таким образом, иод может окислять трехвалентный мышьяк до пятивалентного. Поэтому в нейтральной ( или в слабощелочной) среде мышьяковистую кислоту и ее соли можно титровать раствором иода. [22]
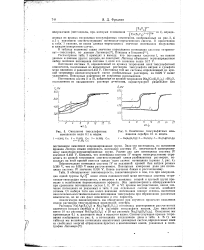 |
Окисление тиосульфатных комплексов меди н. иодом.| Окисление тиосульфатных комплексов серебра н. иодом. [23] |
Первоначально потенциал системы IV из указанной кривой был найден равным 0.380 V, что на 0.025 V ниже рассчитанного. [24]
Расчет потенциала системы по любому из этих двух уравнений приводит к одинаковому результату. [25]
Увеличение потенциала системы в области концентрации серной кислоты от I до 30 н они объясняют преобладанием равновесия ( I) вследствие увеличения активности ионов водорода с ростом концентрации кислоты. [26]
Выражение потенциала системы ( 30) упрощается: F0 - ZpV. Давление, которое может оказывать кристаллическая фаза при своем росте в условиях соприкосновения с питающим, жидким или газовым раствором, может быть названо кристаллизационным давлением. Кристаллизационное давление минерала есть определенная функция химических потенциалов его компонентов и их содержаний в минерале ( вывод соответствующих уравнений см. Кор-жипский, 1953, стр. Минералы, которые при данном составе поро-вых растворов обладают большим кристаллизационным давлением, разрастаются за счет минералов с меньшим кристаллизационным давлением, вызывая их растворение, пока при произвольном составе перового раствора не останется только один минерал с наибольшим кристаллизационным давлением. Этим объясняется мономинералыюсть конечных стадий метасома-тических замещений. [27]
Тем самым потенциал системы адсорбат - адсорбент сводится к потенциалам для адсорбата и адсорбента, взятых в отдельности. В параметры немногих потенциальных функций атом - атом или группа - атом удобно ввести поправки [1], чтобы с помощью этих функций рассчитать термодинамические свойства множества адсорбционных систем. [28]
Вследствие этого потенциал системы Fe3 / Fe практически не может быть измерен. Его можно вычислить с помощью уравнения (3.56); он равен - 0 037 В. [29]
Нормальный окпслптелыю-восстановптельпып потенциал системы Т13 / Т1 ( 25) в одпомолнрном сернокислом р-ре - j - 1 221 в, в хлор-нокислом ( 1 моль, 1000 г П20) - ] - 1 247 в. С водородом он непосредственно реагирует только в особых условиях ( напр. [30]
Страницы: 1 2 3 4