Потенциал - система
Cтраница 4
Неравновесный гН - потенциал системы является сложной функцией концентраций многих соединений, и использование этой величины для анализа кинетики затруднительно. Однако возможно, что гН - потенциал определяется всего парой концентраций, одна из которых велика ( например, [ HBrOsl) и практически не меняется. Тогда колебания гН - поте иди ала отражают колебания одной переменной. [46]
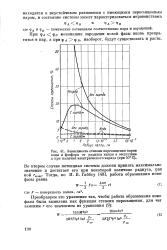 |
Зависимость степени пересыщения паров воды и фосфора от радиуса капли в отсутствие и при наличии электрического заряда ( при 509 С. [47] |
Во втором случае потенциал системы должен принять максимально значение и достигает его при некоторой величине радиуса, рав ной т-макс. [48]
В этом случае потенциал системы обозначают Е и называют стандартным окислительно-восстановительным потенциалом. Его величина характеризует окислительно-восстановительные свойства системы, определяют ее стремление принимать или отдавать электроны и применяется для сравнения окислительно-восстановительных систем. [49]
Чем более положителен потенциал системы, тем более окислительными свойствами она обладает. Потенциалы, которые получаются в системах, содержащих равные концентрации окисленного и восстановленного иопа, наз. [50]
Таким образом, потенциал системы О2 / Н2О становится достаточно положительным для того, чтобы обеспечить окисление золота даже при небольшой концентрации растворенного кислорода. [51]
В хлорной кислоте потенциал системы Pd ( II) / Pd равен 0 987 s [8], поэтому в хлорнокислых растворах палладий ( II) восстанавливается еще легче, чем в солянокислых. [52]
В хлорной кислоте потенциал системы Pd ( II) / Pd равен 0 987 в [8], поэтому в хлорнокислых растворах палладий ( II) восстанавливается еще легче, чем в солянокислых. Склонность к окислению у палладия ( II) выражена очень слабо. Соединения палладия ( IV) типа [ PdX6 ] 2 - могут быть получены при действии на палладий ( II) хлора, брома или иода, но они неустойчивы и в водных растворах постепенно разлагаются с образованием [ PdX4 ] 2 - и выделением свободного галоида. [53]
Относительно высокое значение потенциалов систем 3 / Н2ЗО3 в кислой среде позволяет проводить выделение селена и теллура в элементарной форме под действием различных восстановителей: металлических цинка и кадмия, двухлористого олова, сернистого газа, солянокислого гидразина. Необходимо, однако, подчеркнуть, что следует очень осторожно опираться на приведенные значения потенциалов при оценке возможности протекания той или иной окислительно-восстановительной реакции, участниками которой являются анионы кислородных кислот селена и теллура. Имеется не мало примеров того, когда нормальные потенциалы не увязываются с химическими свойствами кислородных кислот селена и теллура. Показательным является то, что H2SeO4 не восстанавливается таким восстановителем, как сернистый газ, и восстанавливается соляной кислотой. [54]
Малое различие о-в потенциалов систем, составленных из геометрически изомерных ионов, показывает, что геометрически изомерные комплексы платины, как правило, мало отличаются друг от друга по величине свободной энергии. [55]
Страницы: 1 2 3 4