Потенциал - электрод - сравнение
Cтраница 1
Потенциал электрода сравнения не должен зависеть от потенциала индикаторного электрода в ходе измерений и должен оставаться постоянным. [1]
 |
Интегральные кривые титрования. [2] |
Потенциал электрода сравнения в процессе титрования не изменяется. Потенциометрическое титрование может быть основано на реакциях нейтрализации, окисления - восстановления, комплексообразова-ния, осаждения. [3]
Потенциал электрода сравнения не зависит от активности ионов анализируемой среды и должен всегда оставаться постоянным независимо от изменения ее состава. [4]
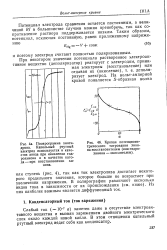 |
Кривая потенциоме-трического титрования хино-на восстановителем ( или гидрохинона - окислителем. [5] |
Потенциал электрода сравнения остается постоянным, а величиной RI в большинстве случаев можно пренебречь, так как сопротивление раствора поддерживается низким. [6]
Фср - потенциал электрода сравнения; Фх - тотенциал металла, измеренный по отношению к электроду сравнения. Потенциал металла имеет положительный знак, когда он присоединен к положительному полюсу измеряющего прибора. [7]
Небольшой односторонний дрейф потенциала электрода сравнения, который при этом наблюдается, особенно в начальный период после заполнения отделения электрода сравнения, практически не мешает анализу, особенно если в это отделение заливают растворы, анионы в которых образуют малорастворимые соли с ртутью. При работе в трех-электродном режиме требования к сопротивлению перегородки менее жесткие, чем в двухэлектродном режиме. [8]
В табл. 7 приведены потенциалы электродов сравнения, рекомендуемых для измерения потенциалов электродов в водных и неводных средах. [9]
В табл. 39 приведены потенциалы электродов сравнения при температуре 20 и 25 С. [10]
Очень важно, чтобы потенциал электрода сравнения был стабилен. [11]
Таким образом, если потенциал электрода сравнения постоянен и равен нулю, и если произведение IR очень мало, то V практически оказывается равным потенциалу индикаторного электрода. [12]
 |
Поляризационные кривые. [13] |
По оси абсцисс откладывают потенциал относительно принятого электрода сравнения, например водородного электрода, по оси ординат - плотности тока на исследуемом электроде. Кривые 1 и 2 ( рис. 3) характеризуют изменение скорости электрохимического восстановления или окисления с изменением потенциала. [14]
Константа k учитывает неравенство потенциалов электродов сравнения и / или / лотенц иалов между жидкими фазами; на потенциал электрода влияет также параметр, называемый потенциалом асимметрии стеклянной мембраны ( Потенциал асимметрии возникает в связи с наличием напряжений и дефектов в стеклянной мембране. [15]
Страницы: 1 2 3 4