Потенциал - ртутный электрод
Cтраница 1
 |
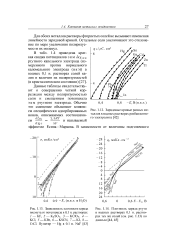
Полярограмма иона Hg ( II на фоне 1 N HNO3.| Полярограммы ртути, мышьяка и сурьмы на фоне 0 25 М Na2S 0 25 М NaOH. [1] |
Потенциал ртутного электрода в щелочных растворах, содержащих сульфид-ионы, сильно сдвинут в отрицательную сторону за счет связывания ртути в комплексные анионы тиосоли. Диффузионный ток восстановления ртути в сульфидно-щелочных растворах наблюдается при потенциале - 0 9 в. [2]
В то время как потенциал ртутного электрода в большинстве случаев зависит от константы устойчивости комплексного соединения титруемого металла с комплексоном, потенциал серебряного электрода не зависит от титруемого вещества и очень быстро достигает постоянного значения. Поэтому применение его более надежно. [3]
 |
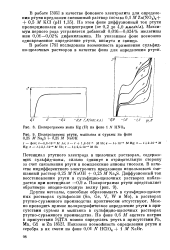
Влияние потенциала на угол смачивания ртути толуолом.| Влияние потенциала на угол. [4] |
Основное достоинство юдели в том, что изменением потенциала ртутного электрода южно плавно регулировать свойства его поверхности в широком щапазоне: от практически гидрофобной ( 6 180) в точке элект-юкапиллярного максимума до полностью гидрофильной ( 8 0) гри высоком отрицательном потенциале. [5]
Предположим далее, что при помощи внешнего источника тока потенциал ртутного электрода сдвинут в область отрицательных зарядов поверхности. [6]
 |
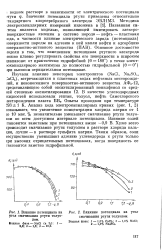
Зависимость интегральной К и дифференциальной с емкости двойного слоя от потенциала ртутного адектсода в растворах NaF. Концентрация NaF, кмоль / мЗ. / - 0 1. 2 - 0 01. [7] |
На рис. 7.5 изображена зависимость интегральной и дифференциальной емкости от потенциала ртутного электрода в растворе поверхностно-неактивного электролита. В области положительных зарядов поверхности ( q 0) наблюдается наиболее высокое значение емкости, что связано с электростатическим притяжением и деформацией анионов в двойном электрическом слое. Катионы сильнее гидра-тированы и меньше поляризуются, поэтому при отрицательных зарядах поверхности ( q 0) расположены дальше от нее, что вызывает менее резкое повышение емкости при увеличении отрицательного заряда поверхности. [8]
 |
Капиллярный электрометр. [9] |
Процесс ионизации ртути термодинамически невозможен, так как при снятии электрокапиллярных кривых потенциал ртутного электрода смещен в отрицательную область. [10]
Данные таблицы свидетельствуют о совершенно четкой корреляции между поляризуемостью соли и смещением потенциала экм ртутного электрода. [12]
Кроме водородной шкалы потенциалов, применяется еще ртутная шкала, за основу которой принят потенциал ртутного электрода, находящийся в условиях, при которых его заряд относительно раствора принят равным нулю. [13]
Например, было найдено, что при десятикратном изменении концентрации раствора азотнокислой закиси ртути потенциал ртутного электрода при 17 меняется на 0 029 в; поэтому z должно быть равно 2, и, следовательно, ионы закисных солей ртути двухвалентны. [14]
 |
Капиллярный электрометр. [15] |
Страницы: 1 2 3 4