Потенциал - ртутный электрод
Cтраница 2
Исходя их этого, определяют изменение поверхностного натяжения на границе ртуть-раствор в зависимости от потенциала ртутного электрода. Эту трубку предварительно кипятят в течение 20 мин в 10 % - ном растворе К2СО3, а затем в дистиллированной воде, промывают дистиллированной водой и ацетоном или эфиром и сушат на воздухе. Резервуар для ртути 4 через блок Р соединен капроновой нитью 11 с рукояткой 10, снабженной микрометрическим винтом. [16]
 |
Схема определения энергии сольватации иона водорода по Измайлову. [17] |
Латимер и других использовали полученное ими свободной гидратации Na для абсолютного потенциала каломельного электрода по от-к потенциалу ртутного электрода в точке электрокапиллярного максимума. Полученная при этом оказалась 0 495 В, в то как экспериментальное 0 48 В. Однако этот факт не может служить доказательством правильности использованного метода расчета, поскольку согласно предположению Латимера и других, электроду, находящемуся в точке электрокапиллярного максимума, приписывать нулевой потенциал по отношению к раствору. Остается неясным, почему радиусы молекул воды, входящих в состав гидрат-оболочек и должны сильно отличаться друг от друга. При Борна не учитывается, что оно справедливо только для сплошного диэлектрика. [18]
Лостояннотоковую полярографию можно применять для количественного определения веществ ( катионов, анионов, молекул), которые в рабочей области потенциалов ртутного электрода ( до - 1 8 В, а при использовании солей тетраалкиламмо-йия в качестве фонового электролита - до - 2 6 В) вступают в электрохимическую реакцию - на ртути. [19]
В окрестности точки эквивалентности равновесная концентрация [ MY ] CM оказывается приблизительно постоянной, и если [ HgY ] также будет постоянной, то потенциал ртутного электрода будет зависеть только от величины CM, которая резко убывает. При более высоких концентрациях ртути ( I) галогенид может осаждаться на поверхности ртутного электрода, вызывая дрейф электродного потенциала. [20]
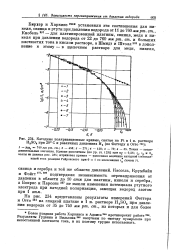 |
Катодные поляризационные кривые, снятые на Pt в 1 н. растворе HaS04 при 20 С и различных давлениях На ( по Феттеру и Отто ш. [21] |
Кассель, Крумбайн и Фойгт171 2М подтвердили независимость перенапряжения от давления в области до 10 атм для платины, никеля и серебра, а Бокрис и Парсонс 257 не нашли изменения потенциала ртутного электрода при катодной поляризации, замещая водород азотом при 1 атм. [22]
Вещество диамагнитно с % - 0 5 Ю - в. Вещество не окисляется по всей области потенциалов ртутного электрода ( вплоть до - 0 5 в), что хорошо согласуется с визуальными наблюдениями его оксидативной устойчивости - оно стабильно на воздухе, способно хроматографироваться, перекристаллизовываться из горячих растворов на воздухе. [23]
Почему как наука электрохимическая кинетика появилась так поздно. Количественное ( линейное) соотношение между потенциалом ртутного электрода, на котором разряжается водородный ион с выделением водорода, и логарифмом скорости процесса, так называемая формула Тафеля, - одно из самых замечательных соотношений в химической науке, потому что оно остается справедливым при изменении плотности тока, определяющей скорость процесса на 12 порядков. Насколько известно, других подобных соотношений во всей химической кинетике не существует. [24]
Независимо от исходного значения потенциала и природы растворителя потенциал ртутного электрода становится более положительным с возрастанием концентрации того же электролита. [25]
Из соотношения (42.12) вытекает, что при t 0 потенциал электрода стремится к оо. Однако, как и при полярографическом методе, в хронопотенциометрии при разомкнутой цепи потенциал ртутного электрода достигает лишь значений, соответствующих началу анодного растворения ртути. [26]
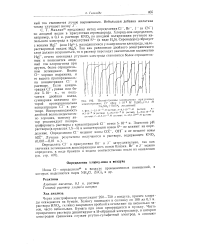 |
Подпрограммы хлорид-иона при разных. [27] |
Так как равновесие двойного электрического слоя должно сохраниться, то в раствор переходит значительное количество Hg2, отчего потенциал ртутного электрода становится более отрицательным и появляется анодный ток хлорид-иона при другом, более отрицательном потенциале. Волна С ] - хорошо выражена, и ее высота пропорциональна концентрации С1 - в растворе. [28]
 |
Схема электрокапиллярной установки Конвея и Гордона. [29] |
На рис. 39 показана использовавшаяся в работе схема. Она состоит из обычного поляризующего устройства постоянного тока с делителем потенциала ( или потенциостатом) и рН - милливольтметра для измерения потенциала ртутного электрода по отношению к стандартному электроду сравнения в третьем отделении ячейки. [30]
Страницы: 1 2 3 4