Потенциал - металлический электрод
Cтраница 1
Потенциал металлического электрода может быть стабильным при равенстве числа электронов, подводимых к нему и отводимых от него в единицу времени. [1]
Потенциал металлического электрода, возникающий при его погружении в раствор, содержащий данное вещество в двух различных степенях окисления. [2]
Потенциал металлического электрода, погруженного в раствор с одноименными ионами, представляет собой функцию электролитической упругости растворения металла и концентрации его ионов. Электролитическая упругость растворения характеризует способность данного металла посылать в раствор ионы. Вследствие этого сам металл заряжается отрицательно, так как из него уходят катионы в раствор, а электроны остаются на поверхности. [3]
Потенциалы металлических электродов зависят от активностей ионов металла в ионном проводнике, а потенциалы газовых электродов - от активности ионов реагирующих газов в ионном проводнике и от парциальных давлений этих газов над электролитом. Стандартные электродные по - тенциалы являются мерой окислительно-восстановительной способности металлов и их ионов, газов и их ионов. [4]
Вычислить потенциал металлического электрода относительно электрода сравнения при следующих условиях. [5]
Ех - потенциал металлического электрода при данной концентрации ионов металла в растворе; Ей - нормальный потенциал металлического электрода ( при концентрации ионов равной единице); Сдое - концентрация ионов металла; R - газовая постоянная, R 8 313 Дж; Т - абсолютная температура; F - число Фарадея, F 96 500 К; и - заряд ионов металла. [6]
Пусть Km - потенциал металлического электрода, а потенциал глубины раствора Ф измеряется с помощью электрода сравнения того же типа, что и рабочий электрод. [7]
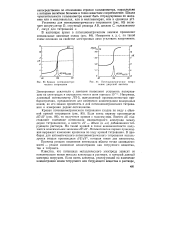 |
Кривая потенциометрического титрования.| Потенциометрическое титрование уксусной кислоты. [8] |
Известно, что потенциал металлического электрода зависит от концентрации ионов металла электрода в растворе, в который данный электрод погружен. [9]
Пусть Vm - потенциал металлического электрода, а потенциал глубины раствора Ф измеряется с помощью электрода сравнения того же типа, что и рабочий электрод. [10]
При дальнейшем увеличении потенциала металлического электрода происходит снижение тока, что связано с появлением зародышей и отдельных участков поверхности, покрытых оксидом. В этой области потенциалов возможно возникновение колебаний тока. [12]
Как получают значение потенциала металлического электрода по водородной шкале потенциалов. [13]
Из уравнения (3.16) следует, что потенциал металлического электрода, на котором установилось равновесие, зависит от активности только катионов металла. Ионы, непосредственно определяющие величину электродного потенциала, называются потен-циалоопределяющими. Как видно из уравнения (3.17), потенциал электрода является стандартным, когда активность потенциало-определяющих ионов в растворе равна единице. [14]
Уравнение ( 242) определяет величину потенциала металлического электрода по отношению к раствору как функцию активной концентрации потенциалоопределяющих ионов. Измерить электродный потенциал можно только составив гальваническую цепь, для чего необходимо использовать второй сравнительный электрод. [15]
Страницы: 1 2 3 4