Потенциал - металлический электрод
Cтраница 3
Когда скорости всех частных процессов сравнимы и ни одной из них в уравнении ( XXV-2) пренебречь нельзя, тогда установившаяся величина потенциала не отвечает ни потенциалу металлического электрода первого рода ( или металлического электрода второго рода, что возможно, если металл покрыт слоем его труднорастворимого соединения), ни потенциалу водородного электрода. [31]
 |
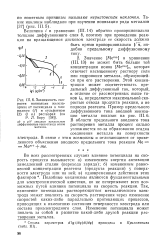
Схема установления компромиссного или стационарного коррозионного потенциала при сравнимых скоростях катодной и анодной реакций. [32] |
Когда скорости всех частных процессов сравнимы и ни одной из них в уравнении ( 716) пренебреь нельзя, тогда установившаяся величина потенциала не отвечает ни потенциалу металлического электрода первого рода ( или металлического электрода второго рода, что возможно, если металл покрыт слоем его труднорастворимого соединения), ни потенциалу водородного электрода. Однако могут быть такие случаи, когда потенциал данного электрода не очень сильно отличается или от потенциала водородного электрода, или от потенциала соответствующего металлического электрода. Действительно, хотя частные токи в уравнении ( 716) не отвечают токам обмена в состоянии равновесия, они все же должны изменяться параллельно с величинами последних. [33]
Отдельные мембранные потенциалы ем последовательно складываются друг с другом, создавая суммарное напряжение системы. В нашем примере потенциалы металлических электродов выбраны одинаковыми и, будучи включены навстречу друг другу, они взаимно компенсируются. Но в общем случае такая компенсация совершенно не обязательна, и эту разность потенциалов тоже надо учитывать. [34]
 |
Зависимость скорости ионизации железа. [35] |
Подобные механизмы являются фундаментальными для электрохимической кинетики, но не исчерпывают всех возможных путей влияния потенциала на скорость реакции. Так, изменение потенциала растворяющегося металлического электрода может повлиять на скорость растворения через изменение скоростей каких-либо параллельно протекающих процессов, приводящих к изменению состояния поверхности электрода или состава приэлектродного слоя. Изменение потенциала может повлечь за собой и развитие какой-либо другой реакции растворения металла. [36]
Если скорости всех частных реакций сопоставимы и ни одной из них нельзя пренебречь, то установившееся значение потенциала не отвечает ни равновесному потенциалу металла, ни равновесному потенциалу окислителя. Однако, на практике наблюдаются случаи, когда потенциал электрода Екор не очень сильно отличается от потенциала соответствующего металлического электрода или равновесного потенциала окислителя. [37]
Восстановление многих химических веществ, неосложненное побочными реакциями, можно изучать полярографически, снимая соответствующие вольтамперные кривые. Например, если в результате полуреакции образуется металл, растворимый в ртути капельного электрода, то при определении потенциала металлического электрода необходимо делать поправку на разность потенциалов между чистым металлом и амальгамой. Потенциал полуволны обычно измеряется по отношению к каломельному электроду сравнения и поэтому включает потенциал жидкостного соединения. [38]
 |
Схема установления компромиссного или стационарного коррозионного потенциала при сравнимых скоростях катодной и анодной реакций. [39] |
Когда скорости всех частных процессов сравнимы и ни одной из них в уравнении ( 716) пренебреь нельзя, тогда установившаяся величина потенциала не отвечает ни потенциалу металлического электрода первого рода ( или металлического электрода второго рода, что возможно, если металл покрыт слоем его труднорастворимого соединения), ни потенциалу водородного электрода. Однако могут быть такие случаи, когда потенциал данного электрода не очень сильно отличается или от потенциала водородного электрода, или от потенциала соответствующего металлического электрода. Действительно, хотя частные токи в уравнении ( 716) не отвечают токам обмена в состоянии равновесия, они все же должны изменяться параллельно с величинами последних. [40]
Если изменение поляризации вызывается приложением внешнего тока, то поляризационная кривая может быть графически представлена зависимостью т л от плотности приложенного тока. Типичный график представлен на фиг. Объектами измерения являются Е - потенциал металлического электрода при плотности приложенного тока i и плотность приложенного тока I, равная IA - ic, т.е. разности между характеристиками процессов анодного раств орения и катодного осаждения. [41]
Если к металлическому электроду приложен отрицательный относительно полупроводника потенциал, то у поверхности полупроводника образуется слой, концентрация основных носителей - дырок в котором больше разности концентраций ионизированных акцепторов и доноров. Этот слой называют обогащенным. Степень этого искривления зон зависит от потенциала металлического электрода и свойства среды, заполняющей промежуток между электродом н полупроводником. [42]
Со стороны этой плоскости, обращенной к раствору, наблюдается неоднородное распределение анионов и катионов - диффузный слой, в котором преобладают анионы. Наличие такого распределения подтверждается существованием области отрицательного заряда, абсолютное значение которого уменьшается с увеличением расстояния х от электрода. Потенциал изменяется в этом случае от ф F ( потенциал металлического электрода) до фр ( потенциал раствора); точка перегиба на кривой изменения потенциала соответствует потенциалу ф2, который является потенциалом плоскости максимального приближения ионов. [44]
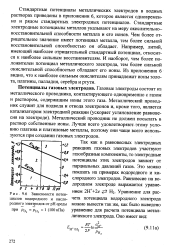 |
Зависимости потенциалов водородного и кислородного электродов от рН среды. [45] |
Страницы: 1 2 3 4
