Потенциал - металлический электрод
Cтраница 4
Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то электродные потенциалы этих электродов зависят от парциальных давлений газов. Уравнение для расчета потенциала водородного электрода можно вывести так же, как было выведено уравнение для расчета потенциала металлического электрода. [46]
 |
Двойной электрический слой на границе электрод - раствор. [47] |
В растворе вблизи заряженной поверхности электрода скапливаются ионы, имеющие заряд, противоположный по знаку заряду поверхности. Поэтому образуется двойной электрический слой ( рис. 2), напоминающий по схеме конденсатор, у которого одна обкладка - поверхность металла, а вторая - слой ионов, находящихся в растворе вблизи поверхности электрода. Разность потенциалов между обкладками конденсатора и представляет собой так называемый электродный потенциал. Потенциал металлического электрода зависит от свойств металла, концентрации раствора, температуры и валентности ионов. [48]
В растворе вблизи заряженной поверхности электрода скапливаются ионы, имеющие заряд, противоположный по знаку заряду поверхности. Поэтому образуется двойной электрический слой ( рис. 2), напоминающий по схеме конденсатор, у которого одна обкладка - поверхность металла, а вторая - слой ионов, находящихся в растворе вблизи поверхности электрода. Разность потенциалов между обкладками конденсатора и представляет собой так называемый электродный потенциал. Потенциал металлического электрода зависит от свойств металла, от концентрации раствора, температуры и валентности ионов. [49]
Стандартные потенциалы металлических электродов в водных растворах приведены в приложении 6, которое является одновременно и рядом стандартных электродных потенциалов. Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Из приложения 6 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [50]
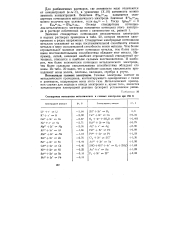 |
Стандартные потенциалы металлических и газовых электродов при 298 К. [51] |
Значения стандартных потенциалов металлических электродов в водных растворах приведены в табл. 20, которая является одновременно и рядом напряжения. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают его ионы. Из табл. 20 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [52]
Стандартные потенциалы металлических электродов в водных растворах приведены в табл. VII. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. [53]
Потенциал металлического электрода, погруженного в раствор с одноименными ионами, представляет собой функцию электролитической упругости растворения металла и концентрации его ионов. Электролитическая упругость растворения характеризует способность данного металла посылать в раствор ионы. Вследствие этого сам металл заряжается отрицательно, так как из него уходят катионы в раствор, а электроны остаются на поверхности. Наоборот, катионы из раствора стремятся перейти на металл, нейтрализуясь свободными электронами, находящимися на поверхности металла. Поэтому потенциал металлического электрода зависит от концентрации одноименных катионов в растворе. [54]
Страницы: 1 2 3 4