Потенциал - серебряный электрод
Cтраница 1
Потенциал серебряного электрода имеет вполне определенную зависимость от концентрации ионов хлора в растворе. Поэтому если такой электрод погрузить в неводный электролит с растворенной в нем нефтью, то по величине его потенциала можно судить о содержании хлоридов в нефти. Зависимость потенциала серебрян-ного электрода от концентрации хлоридов имеет нелинейный, логарифмический характер. Для этого метода характерны непостоянство потенциала при малом содержании солей в нефти, зависимость потенциала от состава растворителя, наличия в растворителе и в нефти различных примесей, в частности соединения серы и непредельных углеводородов. Хотя изменения потенциала от содержания хлоридов довольно значительны и составляют примерно 70 мв при изменении концентрации хлоридов в 10 раз, однако отсутствие стабильности и воспроизводимости потенциала не позволяют рассчитывать на достаточную точность и универсальность этого метода. [1]
Потенциал серебряного электрода зависит от концентрации ионов серебра, на которую в свою очередь влияет присутствие ионов сульфида, так как сульфид вступает в реакцию с ионами серебра, образуя относительно нерастворимые соли. [2]
Когда изменение потенциала серебряного электрода превысит 20 мв / мл, раствор AgNO3 приливают по каплям, пока скачок потенциала не будет пройден, затем снова приливают по 1 мл, а вблизи второй точки эквивалентности-по каплям. [3]
Когда изменение потенциала серебряного электрода превысит 20 мв / мл, раствор AgNO, приливают по каплям, пока скачок потенциала не будет пройден, затем снова приливают по 1 мл, а вблизи второй точки эквивалентности-по каплям. [4]
Аналогичным способом можно выразить потенциал серебряного электрода в растворе, содержащем ион, который образует с ионом серебра растворимый комплекс. [5]
Так, резкий скачок потенциала серебряного электрода в момент переключения зарядного тока на второй ступени с малых значений на большие - явление, которое раньше связывалось со старением анодных продуктов [21], объясняется следующим. При медленных режимах заряда на второй ступени реакционная поверхность серебряного электрода в меньшей степени отличается по составу от переходного слоя, чем при быстрых, поскольку при этом создаются лучшие условия для диффузии ионов кислорода в глубь электрода. Поэтому с уменьшением величины зарядного тока сопротивление серебряного электрода на второй ступени и внутреннее сопротивление аккумулятора возрастают. Как видно из рис. 113, с уменьшением зарядного тока растет величина пика сопротивления, а также величина внутреннего сопротивления аккумулятора на второй ступени. При 12-шс режиме заряда максимум сопротивления равен примерно 0 5 ом, а сопротивление на второй ступени составляет около 0 04 ом. Для 120 - и 600-чос режимов эти величины соответственно равны 0 8; 0 25 ом и 1 0; 0 52 ом. [6]
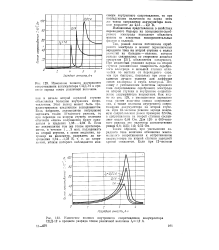 |
Изменение полного внутреннего сопротивления аккумулятора СЦД-12 в процессе заряда током различной величины. [7] |
Так, резкий скачок потенциала серебряного электрода в момент переключенля зарядного тока на второй ступени с малых значений на большие - явление, которое раньше связывалось со старением анодных продуктов [21], объясняется следующим. При медленных режимах заряда на второй ступени реакционная поверхность серебряного электрода в меньшей степени отличается по составу от переходного слоя, чем при быстрых, поскольку при этом создаются лучшие условия для диффузии ионов кислорода в глубь электрода. Поэтому с уменьшением величины зарядного тока сопротивление серебряного электрода на второй ступени и внутреннее сопротивление аккумулятора возрастают. Как видно из рис. 129, с уменьшением зарядного тока растет величина пика сопротивления, а также величина внутреннего сопротивления аккумулятора на второй ступени. [8]
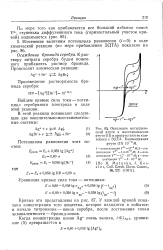 |
Окисление металлической ртути и восстановление ртути ( II в присутствии ее комплекса с ЭДТА. Концентрация ртути ( И 10 - 3М. [9] |
Найдем кривые сила тока - потенциал серебряного электрода в ходе этой реакции. [10]
Эквивалентную точку находят по резкому изменению потенциала серебряного электрода. [11]
В приложении 2 приведены данные для потенциала серебряного электрода в присутствии некоторых ионов. Подобная информация имеется и для других электродных систем. Эти данные часто упрощают вычисления потенциалов полуреакций. [12]
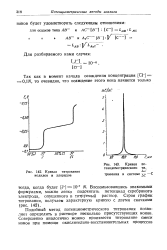 |
Кривая титрования иодидов и хлоридов.| Кривая по-тенциометрического ти. [13] |
Воспользовавшись знакомыми формулами, можно легко подсчитать потенциал серебряного электрода, опущенного в титруемый раствор. [14]
До начала титрования при включенной мешалке определяют первоначальный потенциал серебряного электрода и приступают к титрованию раствором AgNOs. Измерение потенциала серебряного электрода проводят после каждого добавления 0 1 -ил раствора AgNOs. [15]
Страницы: 1 2 3 4