Потенциал - серебряный электрод
Cтраница 3
Хлорсеребряный электрод обратим относительно ионов хлора, при акс11 его стандартный потенциал равен 0 2225 В ( для сравнения приведем потенциал серебряного электрода: Ag - А. [31]
В процессе проявления ионы серебра находятся в равновесии с бромистым серебром и потенциал Е к может быть определен экспериментально как потенциал серебряного электрода, покрытого слоем бромистого серебра. [32]
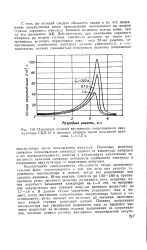 |
Изменение полного внутреннего сопротивления аккумулятора СЦД 12 в процессе разряда током различной величины. / з1 2 а. [33] |
Поскольку величина снижения сопротивления электрода зависит от амплитуды импульса и его продолжительности, понятна и наблюдаемая аналогичная зависимость величины снижения потенциала серебряного электрода и напряжения аккумулятора от параметров импульса. [34]
В то время как потенциал ртутного электрода в большинстве случаев зависит от константы устойчивости комплексного соединения титруемого металла с комплексоном, потенциал серебряного электрода не зависит от титруемого вещества и очень быстро достигает постоянного значения. Поэтому применение его более надежно. [35]
Так как серебряный электрод является обратимым, то восстановление ионов Ag будет происходить, как бы мало ни отклонился при наложении внешней разности потенциалов потенциал серебряного электрода от своего равновесного значения. При прохождении тока концентрация ионов серебра в непосредственной близости от катода уменьшается, а концентрация их в остальной части раствора и у поверхности анода остается постоянной. [36]
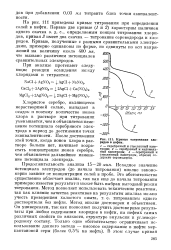 |
Кривые титрования хлоридов в нефти. [37] |
Хлористое серебро, являющееся нерастворимой солью, выпадает в осадок и поэтому количество ионов хлора в растворе при титровании уменьшается, чем и объясняется изменение потенциала серебряного электрода в период до достижения точки эквивалентности. После достижения этой точки, когда ионов хлора в растворе больше нет, начинает возрастать концентрация ионов серебра, чем объясняется дальнейшее изменение потенциала электрода. [38]
Таким образом, при увеличении в растворе концентрации [ х - ], а также аммиака, диссоциация комплекса подавляется, концентрация свободных ионов Ag уменьшается, что приводит к снижению потенциала серебряного электрода. [39]
В сосуд для титрования помещают анализируемый раствор, содержащий ионы С1 -, Вг -, I; опускают индикаторный серебряный электрод и электролитический мостик, соединяющий испытуемый раствор с каломельным электродом сравнения. Измеряют потенциал серебряного электрода. [40]
До начала титрования при включенной мешалке определяют первоначальный потенциал серебряного электрода и приступают к титрованию раствором AgNOs. Измерение потенциала серебряного электрода проводят после каждого добавления 0 1 -ил раствора AgNOs. [41]
Допустим, что объем раствора не меняется во время титрования. Чему равен потенциал серебряного электрода после прибавления 0 %, 90 %, 9S / 0, 99& %, 9У Ь %, 100 1 %, 100 2 %, 101 % эквивалентного количества бромида. [42]
 |
Каломельный электрод. [43] |
Значение потенциала зависит от концентрации соответствующих ионов в растворе. Например, потенциал серебряного электрода, погруженного в раствор соли серебра, изменяется с изменением концентрации Ag - noHOB в растворе. Поэтому, измерив потенциал электрода, погруженного в раствор данной соли неизвестной концентрации, можно определить содержание соответствующих ионов в растворе. [44]
Титрование ведут раствором AgNO3, приливая его вначале по 1 мл. Когда изменение потенциала серебряного электрода превысит 20 мв / мл, раствор AgNO3 приливают по каплям, пока скачок потенциала не будет пройден, затем снова приливают по 1 мл, а вблизи второй точки эквивалентности - по каплям. Результаты титрования записывают по следующей форме. [45]
Страницы: 1 2 3 4