Стандартный потенциал - электрод
Cтраница 1
Стандартный потенциал электродов Е0 для каждого титрования следует рассматривать в вычислениях как уточняемый параметр и все его сомнительные значения и отклонения нужно тщательно исследовать. [1]
Стандартный потенциал электрода равен 44 45 В, активности ионов СГ и СЮз - 0 1; рН 5; Т 298 К. [2]
Стандартный потенциал электрода равен 1 45 В, активности ионов С1ОГ и СГ - 0 1; рН 5; Г 298 К. [3]
Стандартный потенциал электрода равен 1 45 В, активность ионов РЬ2 - 1; рН 3; Т 298 К. [4]
Стандартный потенциал электрода Ag, Ag2O ( т) ОН равен 0 344 в. [5]
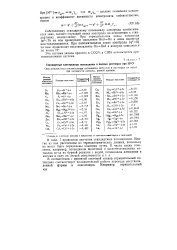 |
Стандартные электродные потенциалы в водных растворах при 25еС. [6] |
Собственному стандартному потенциалу электрода приписывается знак, соответствующий знаку электрода по отношению к стандартному водородному. При отрицательном знаке электрода ( ф 0) на нем происходит окисление Red - - Ox и ионы водорода восстанавливаются. [7]
Под стандартным потенциалом электрода понимается значение его равновесного потенциала, соответствующее протеканию электродной реакции при активностях потенциалопределяю-щих ионов в растворе, равных единице. Переход ионов из одной фазы в другую определяется величиной электрохимического потенциала, который зависит также от степени взаимодействия иона с растворителем. [8]
Еа обозначает стандартный потенциал электрода, состоящего из ионов металла Ме и амальгамы металла Me, а / Мел и / Ме - соответственно коэффициенты активности восстанавливаемого иона металла и металла в амальгаме. [9]
Еи - стандартный потенциал электрода, мВ; К - газовая постоянная; Г - температура раствора, К; z - заряд иона; / - число Фзрадея; с - - активность иона в растворе. [10]
Если же стандартный потенциал электрода смещается во времени, то рекомендуется калибровку проводить до и после измерения в анализируемых пробах и строить калибровочную кривую по средним данным. [11]
Однако значения стандартных потенциалов электродов в разных растворах можно сравнивать друг с другом, причем между значениями для различных электродов в выбранных четырех растворителях наблюдается отчетливый параллелизм. Стремление реакции итти в направлении М - М е, расту-щее вместе с величиной отрицательного потенциала электрода, во всех случаях имеет наибольшую величину у щелочных металлов и наименьшую-у благородных металлов, например серебра. [12]
Потенциометрия позволяет определить стандартный потенциал электрода, если металл дает ионы с несколькими степенями окисления. [13]
Таким образом, стандартный потенциал электрода медь ( 1) - металлическая медь равен 0 521 В относительно НВЭ. [14]
Термический температурный коэффициент стандартного потенциала электрода определяют в том случае, если потенциал электрода при данной температуре измеряют относительно потенциала того же самого электрода при некоторой фиксированной температуре ( обычно 25); если потенциал электрода при данной температуре измеряют относительно потенциала с. [15]
Страницы: 1 2 3 4