Нормальный потенциал - система
Cтраница 3
Область диффузионного тока восстановления элементарного иода ( рис. 21, кривая 3) располагается при потенциалах, лишь немного более отрицательных, чем нормальный потенциал системы Ь / 21 - ( 0 54 в); следовательно, титрование того или иного вещества по току восстановления иода возможно при любом потенциале, меньшем, чем 0 54 в. Практически, однако, удобнее проводить титрование при 0 2 в, так как при более отрицательных потенциалах могут наблюдаться высокие начальные токи ( например, при использовании сильнокислого фона), обусловленные процессом выделения водорода. [31]
Химическое окисление урана ( IV) до урана ( VI) может быть осуществлено любым достаточно сильным окислителем, выбор которых достаточно велик, поскольку нормальный потенциал системы составляет, как указывалось, 0 334 в. [32]
Для того чтобы убедиться, что подобный способ приготовления K2 [ PtJ4 ] не влияет на точность измерения потенциала, мы приготовили таким же методом и K2 [ PtBr4 ] и измерили нормальный потенциал системы [ PtBr4 ] 2 - - f - 2Br - - i [ PtBre ] 2 2e с тетрабромоплатоатом, приготовленным в растворе. [33]
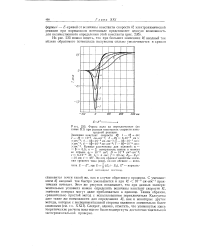 |
Форма волн на переключателе ( по схеме III при разных константах скорости электродной реакции. [34] |
По оси ординат нанесены значения среднего тока ( мка), по оси абсцисс - величина Е - Е, где Е - - ( Ei - - EZ) E - нормальный потенциал системы. [35]
Нормальный потенциал системы Ti4 / Ti3 составляет - 0 04 в, поэтому восстановление титана ( IV) можно осуществить только при помощи сильных восстановителей, в частности ванадием ( II), поскольку нормальный потенциал системы V3 / V2 составляет - 0 25 в. [36]
Нормальный потенциал системы Ti4 / Ti3 составляет - 0 04 в, поэтому восстановление титана ( IV) можно осуществить только при помощи сильных восстановителей, в частности ванадием ( II), поскольку нормальный потенциал системы VS / V2 составляет - 0 25 в. [37]
Бихромат является, как известно, сильным окислителем в кислой среде. Нормальный потенциал системы СггО - / Сг3 составляет [7] 1 33 в. Это, возможно, объясняется уменьшением концентрации свободного бихромата. [38]
Нормальный потенциал системы Fe3 / Fe2 составляет 0 77 в. Еще более отрицательный потенциал имеет вспомогательный анод на основе двухвалентного железа, если в качестве фона применять такой сильный комплек-сообразователь, как комплексен III. [39]
Нормальный потенциал системы Т1 / Т1 - 0 3363 в, металлический таллий растворяется в кислотах с образованием соответствующих солей одновалентного таллия и выделением водорода. Нормальный потенциал системы Т1 / Т13 равен 0 71 в. Металлический таллий не растворяется в щелочах и жидком аммиаке. [40]
Все это указывает на значительную необратимость электродного процесса. Точно так же нормальный потенциал системы ВгО - / Вг - равен 1 16 в в кислой и 0 33 в в щелочной средах. [41]
Все это указывает на значительную необратимость электродного процесса. Точно так же нормальный потенциал системы BrOg / Br - равен 1 16 в в кислой и 0 33 в в щелочной средах. [42]
Едва ли не самым распространенным титрантом при определении Се является сульфат закисного железа [2006], главным образом в форме соли Мора. Ввиду достаточно большой разности нормальных потенциалов систем Се4 / Се3 и Fe3 / Fe2 реакция Се4 с Fe2 протекает полностью и мгновенно, за исключением области вблизи точки эквивалентности, где она несколько замедляется. [43]
VOs, ионы водорода участвуют в электродном процессе, поэтому их присутствие в растворе обязательно. В зависимости от величины нормальных потенциалов систем и количества участвующих ионов водорода электродная реакция возникает при различной концентрации кислоты в растворе. [44]
 |
Окислительно-восстановительные потенциалы комплексных соединений железа по Михаэлису. [45] |
Страницы: 1 2 3 4