Равновесный потенциал
Cтраница 2
Равновесный потенциал 60 - 1 05 в значительно более отрицателен, чем потенциал электрокапиллярного максимума ртути бмако - 0 194 в. [16]
 |
Влияние бихромата калия на катодную поляризацию железа в буферной смеси 0 025 г / л NaCl 0 057 г / л Na2S04 0 530 г / л Na2C03 0 420 г / л NaHC03 ( РН 9. [17] |
Равновесный потенциал этой реакции фрн протекает она, как видно из рис. 2 5, с жением. [18]
Равновесный потенциал такой реакции обычно недалек от равновесного потенциала газового кислородного электрода в кислой среде. Например, у реакции ( 5) он в соответствии с известными данными [27, 28], равен 1 25 в. Поэтому она и становится термодинамически возможной вблизи потенциала выделения кислорода. Действительный термодинамический потенциал освобождаемых в такой реакции атомов кислорода независимо задается адсорбционной компонентой перенапряжения в параллельном процессе его анодного выделения из воды. Следовательно, реальная движущая энергия анодного акта растворения атома железа, а значит, и логарифм его скорости должны с увеличением потенциала возрастать, грубо говоря, пропорционально разрядной компоненте кислородного перенапряжения. [19]
 |
Зависимость скорости коррозии. [20] |
Равновесные потенциалы водородного и кислородного электродов, как было уже показано ранее, являются функцией рН, поэтому процессы водородной и кислородной деполяризации в известной степени от него зависят. Кроме того, рН определяет поведение продуктов коррозии на металле. [21]
Равновесный потенциал зависит от температуры среды, растворимости гидрата закиси железа и ионного произведения воды. [22]
Равновесный потенциал на границе раздела фаз металл-раствор опре деляется его максимальным значением, поэтому для железа любого элек тродного процесса ЭДС рассматриваемого гальванического элемент не может превышать 1 7 - ( - 0 97) 2 67 В. [23]
Равновесные потенциалы, вычисленные по формуле ( XIII, 2), показывают, что для различных металлов ф аев могут быть и положительнее и отрицательнее, чем ф аевн в растворе своих ионов при аме. [24]
Равновесные потенциалы этих процессов ( 1 305 и 1 434 В) очень близки к экспериментально установленным. [25]
Равновесный потенциал для этого процесса экспериментально не может быть определен из-за взаимодействия хлорида - меди ( II) с металлической медью. [26]
Равновесный потенциал - величина электродного потенциала, возникшая на границе металл - раствор. [27]
Равновесный потенциал этой реакции фрно 1 33 В, однако-протекает она, как видно из рис. 8.2, с большим перенапряжением. [28]
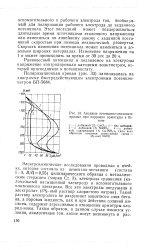 |
Анодные потенциостатические кривые при коррозии арматуры в бетоне. [29] |
Равновесный потенциал и подаваемое на электроды напряжение контролировали катодным вольтметром, который присоединяли к потенциостату. [30]
Страницы: 1 2 3 4