Равновесный потенциал
Cтраница 3
Равновесные потенциалы сульфидов намного электроположительнее равновесных потенциалов металлов, поэтому при потенциале металлического анода сульфиды остаются в неизменном виде и переходят в шлам. Количество шлама, в основном, определяется содержанием серы, в анодах - с его увеличением выход шлама резко возрастает. Помимо сульфидов, в шлам переходят содержащиеся в анодах окислы металлов и шлаковые включения. Основная часть металлов группы платины, являясь значительно более электроположительными, чем никель, также остается в шламе. Последний является поэтому коллектором драгоценных металлов. При содержании серы в анодах около 1 % в шлам переходят - от их содержания в анодах - порядка 1 % никеля, кобальта и железа и 5 - 15 % меди. [31]
Равновесный потенциал анода составляет при комнатной температуре 1 325 В. [32]
Равновесный потенциал марганца равен - 1 05 В. Как и железо, марганец горит на воздухе или в кислороде при нагревании. Он медленно разлагает воду на холоде и быстро при нагреве, образуя гидрат закиси марганца Мп ( ОН) 2, с выделением водорода. Марганец легко растворяется в разбавленных минеральных кислотах, при этом также выделяется водород и образуются соответствующие соли двухвалентного марганца. [33]
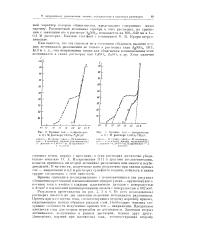 |
Кривые ток - напряжемте в 0 1 М растворе С ( 1804 - 8 / з1ЬО. [34] |
Равновесный потенциал серебра в этих растворах, по сравнению с значением его в растворе AgN03, понижается на 160 - 640 мв в 1 - 0 1 М растворах. Увязать этот факт с концепцией О. К. Кудры затруднительно. [35]
Равновесный потенциал Ni-ДСК-электрода зависит от температуры. [36]
Равновесный потенциал магния очень отрицателен, он составляет - 2 37 В. Относительно высокая коррозионная стойкость магния для его сильно отрицательных электрохимических характеристик целиком определяется его значительной склонностью к пассивации. [37]
Равновесный потенциал вольфрама для реакции W - - - W3 дается по расчету - 0 11 В, а для процесса W - f - - f2H2O - vWO2 4H 4eoH равен - 0 05 В. Стационарный потенциал вольфрама весьма различен в разных условиях; в этом сказывается способность вольфрама, как и молибдена, пассивироваться и в присутствии ионов хлора. [38]
Равновесный потенциал Ni-ДСК-электрода зависит от температуры. [39]
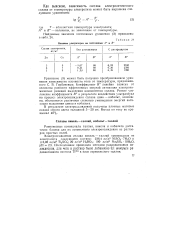 |
Влияние ультразвука на постоянные Д и В. [40] |
Равновесные потенциалы таллия, никеля и кобальта достаточно близки для их совместного электроосаждения из растворов простых солей. [41]
Равновесный потенциал двуокисномарганцевого электрода зависит от концентрации ионов водорода и марганца в растворе. С увеличением концентрации ионов водорода равновесный потенциал электрода увеличивается, а с увеличением концентрации двухвалентного марганца, наоборот, снижается. При разряде происходит потребление ионов водорода, при котором электролит становится менее кислым или даже может подщелачиваться, и накопление двухвалентного марганца; при таких изменениях состава электролита потенциал двуокисномарганцевого электрода сдвигается в отрицательную сторону. [42]
Равновесные потенциалы различных электродов, погруженных в раствор собственной соли, в котором активность ( концентрация) ионов данного металла равна единице ( 1 моль / л), измеренные относительно нормального водородного электрода, называются нормальными потенциалами. [43]
Равновесный потенциал последней реакции отличается от всех остальных тем, что для него коэффициент dcp / dpH равен не - 0 059 В, а имеет втрое более отрицательное значение. Определенные изменения в величинах равновесных потенциалов окислительных процессов связаны с образованием гидроксидных комплексов. [44]
Равновесный потенциал окислительно-восстановительной системы определяется как среднее арифметическое окислительно-восстановительных потенциалов систем, участвующих в реакции. [45]
Страницы: 1 2 3 4