Равновесный потенциал - металл
Cтраница 1
Равновесные потенциалы металлов в раетаораж их комплексных катионов обычно сдвинуты в сторону электроотрицательных значений, и выделение металла протекает с меньшей скоростью по сравнению со скоростью разряда простого катиона. [1]
Равновесные потенциалы металла и водорода в рассматриваемом растворе близки, и при невысоких плотностях тока возможно одновременное их выделение на катоде. [2]
 |
Электрохимические ряды металлов в расплавленных средах. [3] |
Равновесный потенциал металла в расплавленном электролите при данной температуре, как и в случае водных растворов, определяется зависимостью (6.5), где под знаком логарифма будет стоять активность ионов в расплавленном электролите. [4]
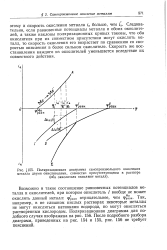
Если равновесный потенциал металла положительнее равновесного потенциала водородного электрода, но отрицательнее равновесного потенциала кислородного электрода ( область / /, рис. 1.1), то восстановление ионов гидроксония термодинамически невозможно. [5]
 |
Поляризационные кривые, отвечающие случаю, когда.| Коррозионные диаграммы, отвечающие катодному контролю ( А и анодному контролю ( Б. [6] |
Понятия о равновесном потенциале металла и окислителя в случае коррозии требуют определенных пояснений. [7]
Приняв, что равновесные потенциалы металла ep и водорода нгер могут быть получены из указанных уравнений как значения е при f 0, определить рН электролита, рассчитать величину плотности тока катодной защиты г к. ЕСТ, при котором протекает коррозия металлам. [8]
 |
Поляризационная диаграмма самопроизвольного окисления. [9] |
Следовательно, если равновесные потенциалы металла и обоих окислителей, а также наклоны поляризационных кривых таковы, что оба окислителя при их совместном присутствии могут окислять металл, то скорость окисления его возрастает по сравнению со скоростью окисления в более сильном окислителе. Скорость же восстановления каждого из окислителей уменьшается вследствие их совместного действия. [10]
Приняв, что равновесные потенциалы металла мер и водорода нгер могут быть получены из указанных уравнений как значения е при i 0, определить рН электролита, рассчитать величину плотности тока катодной защиты 1 к. [11]
Определение точного значения равновесных потенциалов металлов группы железа в системе металл-раствор представляет большие трудности в связи с тем, что истинное равновесие в этой системе при обычных условиях не достигается. Действительно, измеряемые стационарные потенциалы металлов группы железа намного гюложительнее, чем равновесные потенциалы. Так как переходные металлы благодаря большой реакционной способности легко взаимодействуют со средой и их поверхность в водных растворах не существует в чистом виде, то указанное отличие может быть связано с состоянием поверхности электрода. Экспериментально было показано [2], что даже простое соскабливание поверхности электрода резко сдвигает его потенциал в отрицательную сторону. Это свидетельствует о том, что величины стационарных потенциалов металлов группы железа определяются прежде всего состоянием поверхности электрода. [12]
От разности между равновесными потенциалами металла ( ф а н) и окислителя ( р авн) в случае, если кинетика обоих процессов ( анодного и катодного) одинакова. [13]
От разности между равновесными потенциалами металла ( ф а н) и окислителя ( ф авн) в случае, если кинетика обоих процессов ( анодного и катодного) одинакова. [14]
От разности между равновесными потенциалами металла ( ф вИ) и окислителя ( ф аен) в случае, если кинетика обоих процессов ( анодного и катодного) одинакова. [15]
Страницы: 1 2 3 4 5