Равновесный потенциал - электрод
Cтраница 3
 |
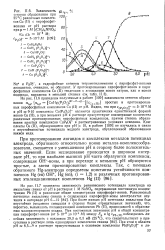
Разрядные кривые эле-ментов с положительными неметаллическими электродами. [31] |
При протекании гетерогенных твердофазных реакций равновесный потенциал электрода зависит только от природы первой и второй фаз, но не от их относительного количества. Поэтому при отключении тока после частичного восстановления или окисления потенциал электрода не зависит от степени окисления. Если же твердофазная реакция гомогенна и образуется фаза переменного состава, то по мере изменения степени окисления плавно меняется и равновесный потенциал. Поэтому разрядные кривые ХИТ, в которых протекают гомогенные твердофазные реакции ( например, реакция восстановления диоксида марганца, кривая / на рис. 18.10) характеризуются постепенным снижением разрядного напряжения, в то время как при протекании гетерогенного процесса ( например, восстановления оксида серебра, кривая 2) разрядное напряжение в течение длительного времени постоянно. [32]
 |
Поляризационные анодные и катодные кривые, отвечающие замедленной химической стадии, в координатах / / реакц-1 ( п lg / / / реакц - ц ( б. [33] |
При замедленных гетерогенных химических стадиях равновесный потенциал электрода и перенапряжение определяются поверхностной концентрацией вещества. Когда поверхностная концентрация потенциалопределяющего вещества достаточно мала и справедлива изотерма Генри, будет наблюдаться прямо пропорциональная зависимость между поверхностной и объемной концентрациями и будут применимы уравнения, полученные для случая замедленной гомогенной химической стадии. [34]
В уравнении (3.30) Е0 - равновесный потенциал электрода при / 0; Е - потенциал электрода, величина которого определяется медленным протеканием электрохимической стадии и диффузии. [35]
Электродвижущая сила ТЭ является разностью равновесных потенциалов электродов, которые определяются уравнением Нернста. [36]
 |
Зависимость степени образования при 25 С различных комплексов Си ( II с пирофосфат. [37] |
На рис. II.7 приведена зависимость равновесного потенциала электрода из амальгамы свинца от рН в растворах 1 М NaN03, содержавших постоянную концентрацию РЬ ( II) и различные общие концентрации пирофосфат-ионов. При более низких рН потенциал амальгамы был неустойчив ( медленно смещался в сторону более отрицательных значений), что, вероятно, вызывалось полимеризацией комплексов РЬ ( II), приводившей к образованию малорастворимого осадка. [38]
НЕРНСТА УРАВНЕНИЕ, описывает зависимость равновесного потенциала электрода от термодинамич. [39]
Статический потенциал может быть равен равновесному потенциалу электрода, если на электроде устанавливается равновесие и побочные реакции отсутствуют. В этом случае ЭДС ХИТ равна напряжению разомкнутой цепи. [40]
И, наконец, при равновесных потенциалах электрода возможно настолько значительное увеличение скорости взаимодействия у поверхности электрода, что это легко заметить по изменениям концентраций компонентов в объеме раствора. [41]
Проверить предложенную формулу можно, измеряя равновесные потенциалы электродов, покрытых разным количеством осадка, в растворах, содержащих потенциалопределяющие ионы. [42]
 |
Классификация электрохимических методов анализа по измеряемому параметру электрохимической ячейки. [43] |
В основе потенциометрических измерений лежит зависимость равновесного потенциала электрода от активности ( концентрации) определяемого иона. [44]
Таким образом, получено выражение для равновесного потенциала электрода в относительной шкале как функция активности простых ионов металла, носящее название уравнения Нернста для электродов первого рода. [45]
Страницы: 1 2 3 4