Равновесный потенциал - водородный электрод
Cтраница 1
Равновесный потенциал водородного электрода устанавливается на электродах из платинированной платины и из других дисперсных металлов платиновой группы как в кислых, так и в щелочных растворах. В щелочных растворах он устанавливается также на электродах из дисперсного никеля, а в кислых - из дисперсного карбида вольфрама WC. Все эти электроды чувствительны к загрязнениям - уже при небольшой концентрации адсорбирующихся примесей они теряют свою активность, и их бестоковый потенциал больше не соответствует равновесному потенциалу водородной реакции. Электроды из неплатиновых металлов, кроме того, чувствительны к окислительным воздействиям. На других металлах водородный потенциал не устанавливается из-за низкого значения тока обмена водорода, а также вследствие искажающего влияния процесса саморастворения, которому подвержены многие металлы ( в частности, железо) в области равновесного водородного потенциала. [1]
Равновесный потенциал водородного электрода находится в линейной зависимости от рН раствора. [2]
Равновесный потенциал водородного электрода устанавливается на платиновой и лалладиевой чернях и никелевом скелетном катализаторе. [3]
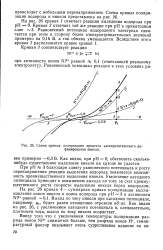 |
Схема кривых поляризации процесса электролитического ра - финирования никеля. [4] |
Равновесный потенциал водородного электрода сдвигается при этом в сторону более электроотрицательных значений примерно на 0 16 В, а ток обмена уменьшается. [5]
Равновесный потенциал водородного электрода устанавливается не сразу, а по истечении довольно продолжительного отрезка времени. [6]
Равновесный потенциал водородного электрода устанавливается не сразу, а по истечении довольно продолжительного времени. [7]
Установление равновесного потенциала водородного электрода возможно только в тех случаях, когда раствор не содержит веществ, способных восстанавливаться на поверхности платинированной платины, и смещать ее потенциал в сторону более положительных значений. Прежде всего это относится к следам кислорода, который, взаимодействуя с адсорбированным на платине водородом, восстанавливается и образует воду. Именно по этой причине необходима очень тщательная очистка газообразного водорода, поступающего в раствор для насыщения платины. [8]
Установление равновесного потенциала водородного электрода возможно только в тех случаях, когда раствор не содержит веществ, способных восстанавливаться на поверхности платинированной платины, и смещать ее потенциал в сторону более положительных значений. Прежде всего это относится к следам кислорода, который, взаимодействуя с адсорбированным на платине водородом, восстанавливается и образует воду. Именно по этой причине необходима тщательная очистка газообразного водорода, поступающего в раствор для насыщения платины. Эта особенность водородного электрода ограничивает область его использования только такими растворами, в которых не содержится окислителей. [9]
 |
Зависимость перенапряжения выделения водорода от плотности тока. [10] |
При равновесном потенциале водородного электрода ( 0 059 рН) перенапряжение равно нулю. [11]
Так как равновесный потенциал водородного электрода в промышленном растворе близок к нулю, а равновесный потенциал кислородного электрода примерно равен 1 2 В, то, следовательно, при катодной и анодной поляризации медного электрода в промышленном электролите будут идти только реакции выделения меди и ее ионизации. [12]
Так как равновесный потенциал водородного электрода в промышленном растворе близок к нулю, а равновесный потенциал кислородного электрода примерно равен 1 2 В, то, следовательно, при катодной и анодной поляризации медного электрода в промышленном электролите будут идти только реакции выделения меди и се ионизации. [13]
Так как равновесный потенциал водородного электрода в промышленном растворе близок к нулю, а равновесный потенциал кислородного электрода примерно равен 1 2 В, то, следовательно, при катодной и анодной поляризации медного электрода в промышленном электролите будут идти только реакции выделения меди и ее ионизации. [14]
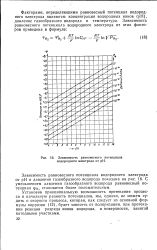 |
S. Зависимость равновесного потенциала водородного электрода от рН. [15] |
Страницы: 1 2 3 4