Равновесный потенциал - водородный электрод
Cтраница 2
Факторами, определяющими равновесный потенциал водородного электрода являются: концентрация водородных ионов ( рН), давление газообразного водорода и температура. [16]
Факторы, определяющие равновесный потенциал водородного электрода, таковы: концентрация водородных ионов ( рН) ( см. табл. 7), давление газообразного водорода и температура. [17]
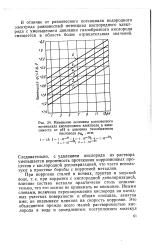 |
Изменение величины равновесного потенциала кислородного электрода в зависимости от рН и давления газообразного кислорода РО, 1 атм. [18] |
В отличие от равновесного потенциала водородного электрода равновесный потенциал кислородного электрода с уменьшением давления газообразного кислорода смещается в область более отрицательных значений. [19]
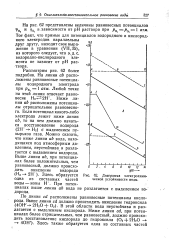 |
Диаграмма электрохимической устойчивости воды. [20] |
На линии ab расположены равновесные потенциалы водородного электрода при рн 1 атм. Ниже линии ab расположены потенциалы отрицательнее равновесного. Если потенциал какого-либо электрода лежит ниже линии ab, то на нем должно начаться восстановление водорода ( 2Н - Н2) с выделением пузырьков газа. Можно сказать, что ниже линии ab вода, находящаяся под атмосферным давлением, неустойчива и разлагается с выделением водорода. При потенциалах выше линии ab вода не разлагается с выделением водорода. [21]
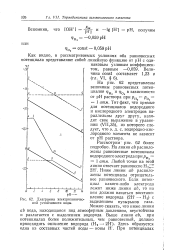 |
Диаграмма электрохимической устойчивости воды. [22] |
На линии ab расположены равновесные потенциалы водородного электрода при рн 1 атм. Ниже линии ab расположены потенциалы отрицательнее равновесного. Если потенциал какого-либо электрода лежит ниже линии ab, то на нем должно начаться восстановление водорода ( 2Н - Н2) с выделением пузырьков газа. Можно сказать, что ниже линии ab вода, находящаяся под атмосферным давлением, неустойчива и разлагается с выделением водорода. [23]
На линии ab расположены равновесные потенциалы водородного электрода при рн - 1 атм. [24]
Если равновесный потенциал металла положительнее равновесного потенциала водородного электрода, но отрицательнее равновесного потенциала кислородного электрода ( область / /, рис. 1.1), то восстановление ионов гидроксония термодинамически невозможно. [25]
Потенциалы здесь и далее приводятся относительно равновесного потенциала водородного электрода в том же растворе. Однако на различных электродах наблюдаются значения, как правило, менее положительные, чем теоретическое значение, на 100 мв и более. Реакция ионизации кислорода, идущая с участием четырех электронов, включает промежуточные стадии с участием одного или двух электронрв. Некоторые из этих стадий могут быть потенциалопределяющими. Кроме того, возможно влияние адсорбированного на поверхности электрода кислорода, а также взаимодействие его с промежуточными продуктами реакции. [26]
Зона /, лежащая ниже линии равновесных потенциалов водородного электрода, отвечает области разложения воды с выделением водорода. [27]
Зона 1, лежащая ниже линии равновесных потенциалов водородного электрода, отвечает области разложения воды с выделением водорода. Зона 3, расположенная выше линии равновесных потенциалов кислородного электрода, соответствует области разложения воды с образованием кислорода. [28]
 |
Ячейка и электроизмерительная схема для снятия кривых. [29] |
Состояние поверхности электрода, устанавливающееся при равновесном потенциале водородного электрода в 1 М растворе HjSO, используется в качестве исходного. [30]
Страницы: 1 2 3 4