Равновесный потенциал - кислородный электрод
Cтраница 1
Равновесный потенциал кислородного электрода, в отличие от потенциала водородного электрода, не устанавливается даже на таком электрохимически не активном металле, как платина. [1]
Теоретическое значение равновесного потенциала кислородного электрода может быть получено лишь при особых условиях предварительной подготовки электрода и тщательной очистке раствора. [2]
Как видно, равновесный потенциал кислородного электрода отрицательнее равновесного потенциала хлорного электрода. [3]
Как видно, равновесный потенциал кислородного электрода более отрицателен, чем равновесный потенциал хлорного электрода. [4]
 |
Поляризационные кривые анодного выделения кислорода и хлора. [5] |
Как видно, равновесный потенциал кислородного электрода отрицательнее равновесного потенциала хлорного электрода. [6]
Рассмотрим теперь уравнения равновесного потенциала кислородного электрода. [7]
В отличие от водородного электрода равновесный потенциал кислородного электрода с уменьшением давления газообразного водорода смещается в область более отрицательных значений. [8]
В отличие от водородного электрода, равновесный потенциал кислородного электрода с уменьшением давления газообразного водорода смещается в область более отрицательных значений. Следовательно, с удалением кислорода из раствора уменьшается вероятность коррозионных процессов, протекающих с кислородной деполяризацией, что часто используется в практике борьбы с коррозией металлов. [9]
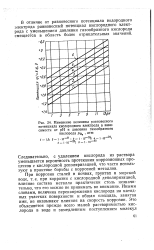 |
Изменение величины равновесного потенциала кислородного электрода в зависимости от рН и давления газообразного кислорода РО, 1 атм. [10] |
В отличие от равновесного потенциала водородного электрода равновесный потенциал кислородного электрода с уменьшением давления газообразного кислорода смещается в область более отрицательных значений. [11]
Равновесный потенциал такой реакции обычно недалек от равновесного потенциала газового кислородного электрода в кислой среде. Например, у реакции ( 5) он в соответствии с известными данными [27, 28], равен 1 25 в. Поэтому она и становится термодинамически возможной вблизи потенциала выделения кислорода. Действительный термодинамический потенциал освобождаемых в такой реакции атомов кислорода независимо задается адсорбционной компонентой перенапряжения в параллельном процессе его анодного выделения из воды. Следовательно, реальная движущая энергия анодного акта растворения атома железа, а значит, и логарифм его скорости должны с увеличением потенциала возрастать, грубо говоря, пропорционально разрядной компоненте кислородного перенапряжения. [12]
 |
Поляризационные кривые восстановления кислорода на сажевом электроде с адсорбированной лакказой ( J и тирозиназой ( 2 в нейтральном буферном растворе. [13] |
Значение потенциала 1 21 В, близкое к равновесному потенциалу кислородного электрода, устанавливается на электродах из сажи, которые предварительно выдерживались в растворе лакказы ( 10 - 5 М) в течение суток. Адсорбция фермента на электродах из сажи практически необратима. Небольшое отклонение от теоретического значения равновесного потенциала, по-видимому, вызвано локальным увеличением рН в слое адсорбированного белка по сравнению с рН в объеме раствора. [14]
 |
Диаграмма электрохимической устойчивости воды.| Нормальный элемент Вестона. [15] |
Страницы: 1 2 3 4