Равновесный потенциал - кислородный электрод
Cтраница 2
Выше линии cd, когда потенциал более положителен, чем равновесный потенциал кислородного электрода, на электроде будет идти процесс выделения кислорода. [16]
С учетом парциального давления кислорода в воздухе ( 0 2 МПа) равновесный потенциал кислородного электрода будет равен 0 391 В; фактически значение потенциала ( в 7 моль / л растворе КОН) составляет лишь 0 1 - 0 2 В. [17]
С учетом парциального давления кислорода в воздухе ( 0 2 МПа) равновесный потенциал кислородного электрода будет равен 0 391 В; фактически значение потенциала ( в 7 моль / л растворе КОН) составляет лишь 0 1 - 0 2 В. [18]
Если равновесный потенциал металла положительнее равновесного потенциала водородного электрода, но отрицательнее равновесного потенциала кислородного электрода ( область / /, рис. 1.1), то восстановление ионов гидроксония термодинамически невозможно. [19]
Величины - 0 414 я и - 0.815 е представляют собэн значения равновесных потенциалов соответственно водородного и кислородного электрода в нейтральной среде. [20]
Кислородная деполяризация термодинамически возможна в тех случаях, когда равновесный потенциал металла отрицательнее равновесного потенциала кислородного электрода в данных условиях. [21]
Так как равновесный потенциал водородного электрода в промышленном растворе близок к нулю, а равновесный потенциал кислородного электрода примерно равен 1 2 В, то, следовательно, при катодной и анодной поляризации медного электрода в промышленном электролите будут идти только реакции выделения меди и се ионизации. [22]
Так как равновесный потенциал водородного электрода в промышленном растворе близок к нулю, а равновесный потенциал кислородного электрода примерно равен 1 2 В, то, следовательно, при катодной и анодной поляризации медного электрода в промышленном электролите будут идти только реакции выделения меди и ее ионизации. [23]
В области, расположенной выше линии cd, где потенциал более положителен, чем равновесный потенциал кислородного электрода, на электроде будет идти процесс выделения кислорода. [24]
Так как равновесный потенциал водородного электрода в промышленном растворе близок к нулю, а равновесный потенциал кислородного электрода примерно равен 1 2 В, то, следовательно, при катодной и анодной поляризации медного электрода в промышленном электролите будут идти только реакции выделения меди и ее ионизации. [25]
Наиболее важное значение в процессах коррозии металлов имеет реакция электровосстановления кислорода, благодаря положительному значению равновесного потенциала кислородного электрода. [26]
Наиболее важное значение в процессах коррозии металлов имеет реакция электровосстановления кислорода, благодаря весьма положительному значению равновесного потенциала кислородного электрода. [27]
Для выделения газообразного кислорода из растворов кислот необходимо, чтобы потенциал анода был более положительным, чем равновесный потенциал кислородного электрода ( 1 23 в при GH 1), на величину кислородного перенапряжения, отвечающую данной плотности тока. Однако еще до достижения такого высокого положительного потенциала большинство металлов становится термодинамически неустойчивыми, и вместо реакции выделения кислорода идет процесс их анодного растворения. Для изучения кинетики выделения кислорода из кислых сред можно использовать поэтому только металлы платиновой группы и золото ( стандартные потенциалы которых положительнее потенциала кислородного электрода), а также некоторые другие металлы, защищенные от растворения в кислотах стойкими поверхностными окислами. В щелочных растворах, где равновесный потенциал кислорода менее положителен ( при аэн - 1 он составляет около 0 41 в), в качестве анодов применяют также металлы железной группы, кадмий и некоторые другие. Установлено, что в условиях выделения кислорода поверхность всех металлов, включая платину и золото, оказывается в большей или меньшей степени окисленной и поэтому кислород выделяется обычно не на самом металле, а на его окислах. [28]
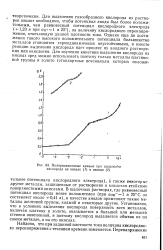 |
Поляризационные кривые при выделении кислорода на никеле ( / и свинце ( 2. [29] |
Для выделения газообразного кислорода из растворов кислот необходимо, чтобы потенциал анода был более положительным, чем равновесный потенциал кислородного электрода ( 1 23 в при ян 1 и 25), на величину кислородного перенапряжения, отвечающую данной плотности тока. Однако еще до достижения такого высокого положительного потенциала большинство металлов становится термодинамически неустойчивыми, и вместо реакции выделения кислорода идет процесс их анодного растворения или окисления. [30]
Страницы: 1 2 3 4