Ионизационный потенциал
Cтраница 1
Ионизационные потенциалы, наряду с другими характеристиками веществ, являются теми исходными величинами, которые необходимы для установления зависимости реакционной способности от структуры методами физической органической химии. Особенно важны данные по ионизационным потенциалам для исследований комплексов с переносом зарядов, которые имеют все возрастающее значение для интерпретации спектроскопических характеристик, свойств растворов и механизмов реакций. Прочность связи в таких комплексах обусловлена частичным или полным переносом электрона от донора к акцептору. Ионизационный потенциал молекулы-донора - один из факторов, который определяет энергию, необходимую для такого переноса. [1]
Ионизационный потенциал закономерно изменяется в группах и периодах системы элементов. Ионизационный потенциал атомов элементов одной и той же группы периодической системы, как правило, последовательно уменьшается от элемента - родоначальника группы к элементу, завершающему эту группу. [2]
Ионизационный потенциал является мерой способности элемента проявлять восстановительные свойства. Эти свойства проявляются тем сильнее, чем ниже величина ионизационного потенциала. [3]
Ионизационный потенциал и сродство к электрону определяют тип образования связи. В природе химических реакций заложена тенденция, направленная в сторону образования веществ, характеризующихся прочными связями. В этом процессе заключается выигрыш энергии. [4]
Ионизационный потенциал и величина смещения каких-либо собственных полос поглощения молекул-акцепторов протона при вступлении их в водородную связь могут служить мерой относительной электронодонорной способности только в ряду однотипных молекул отдельного класса соединений. Так, для незамещенных сложных эфиров Avco больше, чем для кетонов, хотя последние обладают, по-видимому, более сильными электронодонорными свойствами. [6]
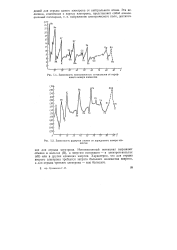 |
Зависимость радиусов атомов от порядкового номера элементов. [7] |
Ионизационный потенциал выражают обычно в вольтах ( В), а энергию ионизации - в электрон-вольтах ( эВ) - или в других единицах энергии. Характерно, что для отрыва второго электрона требуется затрата большего количества энергии, а для отрыва третьего электрона - еще большего. [8]
Ионизационные потенциалы увеличиваются в следующем порядке: / 1 / 2С з / л так как удаление электрона от электронейтрального атома происходит легче, чем от иона. [9]
Ионизационный потенциал - это то наименьшее напряжение электрического поля в вольтах, которое необходимо и достаточно для возникновения процесса ионизации. [10]
Ионизационные потенциалы могут быть также рассчитаны из потенциалов появления А определенного иона в масс-спектре стабильных молекул. [11]
Ионизационные потенциалы непосредственно не могут быть связаны с обычными реакциями образования карбониевых ионов в растворе, такими, как реакция гетеролиза. На рис. 4.2 представлена взаимосвязь между термохимическими параметрами, которые необходимо учитывать для показанных на диаграмме циклов. [12]
Ионизационные потенциалы изменяются нелинейно - минимальное значение для атома кадмия. [13]
Ионизационный потенциал С2Н3С1 получается на 0 51 эв ниже, чем ионизационный потенциал С2Н4 - Вследствие высокого сродства хлора к электрону на основании простого индуктивного эффекта можно было бы ожидать противоположного изменения. [14]
Ионизационные потенциалы SiF4 и SiCl4 равны соответственно 15 4 и 11 6 в. Значительные количества SiF4 получаются как побочный продукт суперфосфатного производства. Фтористый кремний весьма ядовит. [15]
Страницы: 1 2 3 4 5