Ионизационный потенциал
Cтраница 3
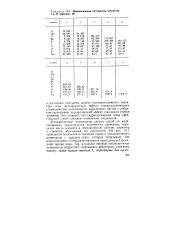 |
Ионизационные потенциалы элементов I и II периодов, эВ. [31] |
Ионизационные потенциалы служат одной из количественных характеристик химических элементов, определяя место элемента в периодической системе, характер и свойства образуемых им соединений. На рис. 19.1 приводится взаимосвязь значений первого ионизационного потенциала с зарядом ядра, которая показывает, что ионизационные потенциалы являются периодической функцией заряда ядра. [32]
Ионизационный потенциал этой молекулы равен 11 2 эв. Предполагают, что ионы могут возникать в процессе образования пары. [33]
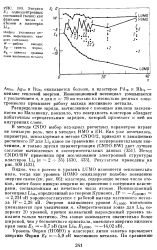 |
Энергия EI однозлектронвых состояний ( точки как функция числа п атомов в кластерах Lin. [34] |
Ионизационный потенциал уменьшается с увеличением и, и для п 79 он только на несколько десятых элек-тронвольт превышает работу выхода массивного металла. [35]
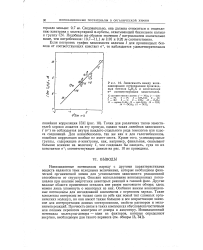 |
Зависимость между ионизационными потенциалами производных бензола CgHgX и константами а соответствующих заместителей. [36] |
Ионизационные потенциалы наряду с другими характеристиками веществ являются теми исходными величинами, которые необходимы физической органической химии для установления зависимости реакционной способности от структуры. Описано использование ионизационных потенциалов при анализе энергетики некоторых реакций в газовой фазе. [37]
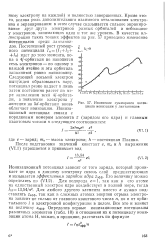 |
Изменение суммарного потенциала ионизации у лантаноидов. [38] |
Ионизационный потенциал зависит от того заряда, который проникает от ядра к данному электрону сквозь слой предшествующих и называется эффективным зарядом ядра гэфф. Для любого другого элемента вместо z нужно подставлять г3фф, так как в сложных атомах энергия отрыва электро-на зависит не только от главного квантового числа п, но и от орбитального / и электронной конфигурации в целом. [39]
Ионизационный потенциал выражают обычно в вольтах ( В), а энергию ионизации - в электронвольтах ( эВ) или в других единицах энергии. Характерно, что для отрыва второго электрона требуется затрата большего количества энергии, а для отрыва третьего электрона - еще большего. [40]
Ионизационный потенциал, электроотрицательность и окислительно-восстановительный потенциал рез-ро снижаются при переходе к висмуту. [41]
Ионизационный потенциал является мерой способности элемента проявлять восстановительные свойства. Эти свойства проявляются тем сильнее, чем ниже величина ионизационного потенциала. [42]
Ионизационный потенциал и сродство к электрону определяют тип образования связи. В природе химических реакций заложена тенденция, направленная в сторону образования веществ, характеризующихся прочными связями. В этом процессе заключается выигрыш энергии. Чем слабее связь, тем меньше энергии Е нужно затратить на ее разрыв. [43]
 |
Зависимость радиусов атомов от порядкового номера элементов. [44] |
Ионизационный потенциал выражают обычно в вольтах ( В), а энергию ионизации - в электрон-вольтах ( эВ) или в других единицах энергии. Характерно, что для отрыва второго электрона требуется затрата большего количества энергии, а для отрыва третьего электрона - еще большего. [45]
Страницы: 1 2 3 4 5