Ионизационный потенциал
Cтраница 4
Ионизационный потенциал является типичным периферическим свойством атома, поскольку речь идет об отрыве внешних электронов. Из рис. 150 видно, что в максимумах кривой располагаются благородные газы, которые характеризуются инертностью и в химическом отношении. [46]
Ионизационный потенциал высшей занятой моле - кулярной орбитали органического пероксидного соединения в существенной мере зависит от величины меж - плоскостного угла в вследствие взаимодействия орбиталей неподеленных пар электронов кислородных атомов пероксидной, группы. [47]
Ионизационный потенциал является количественной характеристикой металлических свойств атома. Металлы занимают наиболее низкие уровни ионизационного потенциала ( наименьшие из них у щелочных металлов), а благородные газы ( Не, Ne, Ar, Кг, Хе) - наиболее высокие. [49]
Ионизационные потенциалы и потенциалы появления, по крайней мере теоретически, являются мерой подпороговой энергии разложения и не должны в такой же степени зависеть от многих факторов, как величина Z, на которую влияют процессы фрагментации. [51]
Ионизационный потенциал характеризует легкость отдачи атомом электрона, и чем меньше этот потенциал, тем сильнее выражены металлические свойства элемента, и наоборот ( см. гл. [52]
Ионизационные потенциалы пиридина и бензола весьма близки: 9.23 и 9.245 эв. [53]
Ионизационные потенциалы алюминия первый, второй и третий значительно меньше соответствующих ионизационных потенциалов бора. [54]
Ионизационные потенциалы тиофа - нов. [55]
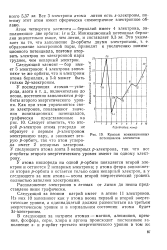 |
Кривая ионизационных потенциалов элементов. [56] |
Ионизационный потенциал бериллия значительно выше, чем лития, и составляет 9 3 эв. [57]
Ионизационный потенциал бора равен 8 296 в, что характеризует его как неметаллический элемент, проявляющий и восстановительные и окислительные свойства. [58]
Ионизационный потенциал гелия особенно высок ( 24 58 эв) и превышает почти в три раза потенциал бериллия ( 9 32 эв), разница свойств этих элементов еще более выражена, чем у водорода и лития, но это не должно мешать размещению их в одной и той же второй группе. Атомы щелочноземельных металлов и металлов подгруппы цинка имеют пару внешних s - электронов и в нормальном состоянии нуль-валентны так же, как и гелий; возбуждение, необходимое для разрушения электронной пары, для них велико и снижает суммарный тепловой эффект образования химических соединений металлов второй группы: особенно это заметно на соединениях атомов ртути с их особенно большими потенциалами ионизации ( 10 43А) и возбуждения, что влечет за собой жидкое состояние ртути при обычных условиях и ее летучесть. Можно предполагать, что эка-ртуть в случае превьь шения ее ионизационного потенциала по сравнению с потенциалом ртути будет при комнатной температуре еще ближе к газообразному состоянию и, возможно, будет до известной степени походить по своим свойствам на инертные одноатомные газы. [59]
Ионизационные потенциалы Еп и Е т следует рассматривать как константы, и выражение для энергии диссоциации не зависит от них. Следовательно, наиболее интенсивными будут токи таких осколочных ионов, которые образуются при разрыве связей с максимально большим v; легкие несут положительный заряд осколка. Из рассмотрения табл. 1 следует, что для октанов наиболее интенсивными должны быть токи ионов С3Н и С4Ш, что подтверждается на опыте. Мы не видим причин, по которым образование осколков определенной длины не происходило бы с наибольшей вероятностью и для алканов более высокого молекулярного веса. По-видимому, и в этих случаях имеют место последовательные процессы диссоциации. [60]
Страницы: 1 2 3 4 5