Электродный потенциал - сталь
Cтраница 1
 |
Влияние нитрита натрия на. [1] |
Электродный потенциал стали с изменением концентрации ингибитора меняется следующим образом: малые концентрации ингибитора слабо изменяют значение потенциала; при - 5 - 10 - 2 моль / л отмечается резкое смещение потенциала в положительную сторону, которое сопровождается увеличением истинной скорости коррозии. Дальнейшее увеличение концентрации ингибитора вызывает сдвиг потенциала в положительную сторону, однако не такой сильный, как малые и средние концентрации. [2]
Электродный потенциал стали в разбавленных электролитах при добавлении силикатов смещается в отрицательную сторону, становясь со временем все более отрицательным. Это свидетельствует о том, что катодный процесс тормозится. При высоких концентрациях силиката, близких к защитным, потенциал стали сдвигается в положительную сторону. Способность силикатов сдвигать потенциал железа в зависимости от концентрации как в отрицательную, так и в положительную сторону свидетельствует о том, что этот ингибитор вмешивается как в анодную, так и в катодную реакцию. [3]
Электродный потенциал стали и сплавов олова в присутствии нитрита натрия заметно изменяется в положительную сторону. [4]
Электродный потенциал стали в грунте характеризует положение равновесия между скоростями электрохимических анодных и катодных процессов, протекающих на поверхности металла. [5]
Электродные потенциалы стали и чугуна в растворе 2 близки между собой и устанавливаются через 60 мин. При насыщении раствора На С & аммиаком и С02 ( раствор 3) наблюдается сдвиг стационарного потенциала в положительную сторону. [6]
Электродный потенциал стали в водных вытяжках из раствора хлорсульфированного полиэтилена ( рис. 9.18) через 60 мин выдержки сдвигается до потенциала - 280 мВ, и образец подвергается сильной коррозии. В вытяжке из модельной системы, содержащей 2 5 % отвердителя, потенциал стали в течение 30 мин становится равным - 40 мВ и в дальнейшем не изменяется. При увеличении содержания отвердителя в модельной системе наблюдается аналогичная картина. [8]
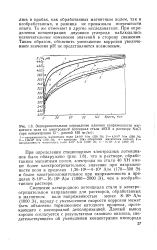 |
Экспериментальное определение влияния напряженности магнитного поля на электродный потенциал стали 40ХН в растворе МаС1 ( при концентрации С1 -, равной 150 мг / кг. [9] |
Смещение электродного потенциала стали в электроотрицательном направлении для растворов, обработанных в магнитном поле напряженностью менее 8 - Ю4 А / м ( 1000 Э), наряду с уменьшением скорости коррозии может быть объяснено торможением катодного процесса, протекающего с кислородной деполяризацией. [10]
Значения электродных потенциалов стали под другими покрытиями показывают, что они не оказывают пассивирующего действия на арматуру. [11]
С введением в электролит молибдата натрия электродный потенциал стали непрерывно сдвигается в положительную сторону вплоть до защитной концентрации. Сопоставление кривой изменения интенсивности коррозии с кривой изменения потенциала показывает, что сдвиг потенциала в положительную сторону может сопровождаться как увеличением интенсивности коррозии, так и ее уменьшением. [12]
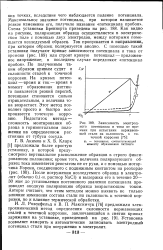 |
Зависимость электродного потенциала и тока от времени при испытании нержавеющей стали на склонность к точечной коррозия. ф. - потенциал, соответствующий моменту образования питтинга. [13] |
Установка позволяет измерять и автоматически записывать электродный потенциал стали при погружении в электролит. [14]
В связи с тем, что электродный потенциал стали с увеличением напряжения при коррозиоппо-усталостннх испытаниях становится более отрицательным, представлялось весьма целесообразным проследить за разностью между электродными потенциалами двух образцов, из которых один испытывает переменные напряжения, а другой находится без напряжения. Приведенные выше результаты измерений электродных потенциалов при различных напряжениях давали основание предполагать, что на счет разности потенциалов такой пары образцов ( один под напряжением, другой - без напряжения) будет возникать гальваническая ( коррозионная) пара, силу тока которой экспериментально можно замерить: Опыты в этом направлении надо было поставить таким образом, чтобы исследуемая пара образцов находилась и совершенно одинаковых усло-ниях за исключением фактора напряжения. [15]
Страницы: 1 2 3 4
