Электродный потенциал - сталь
Cтраница 3
Аналогичный способ кош акта образца с коррозионной средой был использован Эвансом ( 98 ] при измерении электродных потенциалов стали; под напряжением. [31]
На рис. 22 показано влияние времени предварительной выдержки стального электрода в атмосфере летучих ингибиторов на начальное значение электродного потенциала стали. Как видно, с увеличением времени выдержки потенциал электрода заметно сдвигается в положительную сторону; наибольший сдвиг вызывают чистые амины, их соли слабее изменяют потенциал. Объясняется это более высоким давлением паров аминов по сравнению с давлением паров И Х солей. [32]
 |
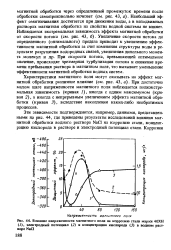
Изменение стационарного потенциала стали в 10 % - ных водных суспензиях хроматных пигментов. [33] |
Об увеличении эффективности ингибирующего действия хроматов [3] с повышением их растворимости в воде можно судить по изменению электродного потенциала стали, помещенной в водные вытяжки пигментов ( рис. 1 - 3): кальциевый крон, лучше растворимый в воде, больше облагораживает ( делает электроположительной) поверхность стали, чем малорастворимый оксихромат цинка. Если, например, использовать смешанный бариево-калие-вый хромат после отделения водной вытяжки и высушивания, то он полностью теряет антикоррозионные свойства. [34]
Основной легирующий элемент нержавеющих сталей - хром, который повышает механические свойства стали и способствует образованию на ее поверхности тонкого слоя окислов, облагораживающего электродный потенциал стали и повышающего ее коррозионную стойкость. [35]
 |
Влияние напряженности магнитного поля на коррозию стали марки 40ХН ( 1, электродный потенциал ( 2 и концентрацию кислорода ( 3 в водном растворе Nad. [36] |
Эти зависимости подтверждаются, например, данными, представленными на рис. 44, где приведены результаты исследований влияния магнитной обработки водного раствора Nad на коррозию стали, концентрацию кислорода в растворе и электродный потенциал стали. [37]
Иллюстрацией использования электрохимических методов могут служить данные по сравнительной оценке устойчивости стали 4X13 в двух биологически активных средах. Значения электродного потенциала стали в контрольной ( стерильной) питательной среде и в присутствии культуры Trichoder - ma lignorum находятся в пределах пассивной области, установленной при измерении анодных характеристик, что свидетельствует об отсутствии влияния этих грибов на коррозионную устойчивость стали. [38]
Коррозионная стойкость достигается при введении в сталь элементов, образующих на ее поверхности тонкие и прочные оксидные пленки, т.е. с помощью явления пассивации. При этом повышается электродный потенциал стали. Наилучший из этих элементов - хром. При введении в сталь более 12 % хрома ее электродный потенциал возрастает скачкообразно и она становится устойчивой против коррозии в атмосфере, воде, ряде кислот, щелочей и солей. Стали, содержащие меньшее количество хрома, подвержены коррозии точно так же, как и углеродистые стали. В технике применяют хромистые и хромони-келевые коррозионностойкие стали. [39]
Сравнивая результаты но коррозионно-усталостной прочности, полученные для стали 45 с различной поверхностной обработкой ( см. табл. 13), с данными измерений электродных потенциалов образцов с. Чем больше разблагораживается электродный потенциал стали в условиях коррозионно-усталостних испытаний, тем меньше ее предел коррозионной выносливости. [40]
Сопоставление кривых время - потенциал, соответствующих различным видам поверхностной ( Обработки образцов, испытанных в условиях коррозионной усталости при одном и том же напряжении, равном 23 3 KZIMM, показывает, что электродный потенциал неунрочненной ( шлифованной) стали разблагора-живается быстрее, чем поверхностно-упрочненной стали. Наиболее медленно понижается электродный потенциал поверхностно-закаленной стали; промежуточное положение к этом отношении занимают образцы, наклепанные дробью и обкатанные роликами. [41]
Перечисленные недостатки и неудобства в измерениях заставили отказаться от контакта образна с коррозионной средой при номоши смоченной фильтровальной бумаги и перейти к измерениям электродных потенциалов в небольшой ванночке. Схема установки для измерения; электродных потенциалов стали под напряжением в ванночке, приведен. [42]
Было показано [12], что в его присутствии электродный потенциал стали сдвигается в отрицательную сторону. Гексаметафосфат натрия замедляет скорость катодной реакции; со временем повышается прочность защитной пленки и замед-л яется скорость анодной реакции. [43]
Было показано [12], что в его присутствии электродный потенциал стали сдвигается в отрицательную сторону. Гексаметафосфат натрия замедляет скорость катодной реакции; со временем повышается прочность защитной пленки и замедляется скорость анодной реакции. [44]
Установившийся после 1 - 2 суток выдержки электродный потенциал покрытия в 1 % - ных растворах различных органических кислот, молоке, яблочном соке на 0 15 - 0 425 в ниже электродного потенциала стали в тех же растворах. [45]
Страницы: 1 2 3 4