Заместитель
Cтраница 3
Заместители, обладающие 1 ( СН3) - или Т - эффектом ( ОСН3, ОН, МН2), сдвигают потенциалы полуволн к более отрицательным значениям, тогда как потенциалы полуволн веществ с - I-заместителями ( С1, Вг, I) или - Т - заместителями ( NO2, СООН) сдвинуты к более положитель -, ным значениям по сравнению с незамещенными соединениями. [31]
Заместители, в меньшей степени способные к сопряжению, например галогены, карбонильные, арильные и алкильные группы, увеличивают реакционную способность двухвалентного углерода в приведенном порядке. Среди дигалокарбенов наибольшего распределения зарядов следует ожидать в случае дифторкарбена. Полупериод жизни такого карбена в растворе [6] ив газовой фазе [7] составляет 0 5 и 20мсек соответственно. Таким образом, несмотря на сопряжение, дифторкарбен представляет собой неустойчивую промежуточную частицу, хотя и существует примерно в 103 раз дольше метилена. [32]
Заместители в положении 2, как наиболее близко расположенные к карбонильным группам, влияют на частоты карбонильных полос. Для некоторых заместителей ( СН2С1, CH2J, NH2) суммирование донорного и акцепторного действия исключает изменение частоты. Влияние заместителей в положении 2 на А весьма мало и, очевидно, представляет собой совокупность различных эффектов, которые в настоящее время не могут быть надлежащим образом оценены раздельно. [33]
Заместители в положении 4 незначительно, за исключением NOg. [34]
Заместители - карбонильная, нитрильная и нитрогруппы - уменьшают плотность электронов двойных С - С-связей и повышают их полярность. Для таких активированных двойных связей электрофильное присоединение не является уже типичным. Их реакции будут рассмотрены как процессы замещения у винилогичных соединений в гл. [35]
Заместители в положении 3 в 1-гидрокси - 2-карбониларенах повышают прочность водородной связи за счет приближения карбонильной группы к гидроксильной. Однако подобного рода действие в случае объемистых заместителей может вытеснить карбонильную группу из плоскости кольца и ослабить водородную связь. [36]
Заместитель направляется в орто - или ара-положение, как и при других. Незамещенные полициклические ароматические соединения, кроме нафталина, фенантрена и хризена, взаимодействуют с реагентами Вильсмейера, давая с хорошими выходами альдегиды ( табл. 5.3.6), и часто это служит наилучшим методом их синтеза, поскольку Практически эта реакция чрезвычайно проста. Когда она только была открыта, лучшим реагентом считался МФА, а сорастворителем служил о-дихлорбензол. [37]
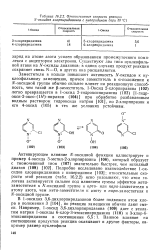 |
Относительные скорости реакции N-оксидов хлорпиридазинов с пиперидином ( при 50 С. [38] |
Заместители в кольце повышают активность Л - оксидов к ну-клеофильному замещению, причем заместитель в а-положении к М - оксидной группе обычно сильнее влияет на реакционную способность, чем такой же р-заместитель. Оксид 2-хлорпиразина ( 102) легко превращается в 1-оксид 2-гидроксипиразина ( 103) [ 1-гидр-окси - 2-оксо - ( 1 Я) - пиразин ( 104) ] при обработке разбавленным водным раствором гидроксида натрия [101], но 2-хлорпиразин и его 4-оксид ( 105) в тех же условиях устойчивы. [39]
Заместители, изменяющие скорость нитрования 163 ел. [40]
Заместители в ароматическом ядре фенилэтиламида оказывают существенное влияние на стадию электрофильного замыкания цикла. [41]
Заместители в кольце и растворители влияют на перегруппировку тетразолов так же, как и в ряду триазолов. [42]
Заместители с - - эффектом иногда называются антиауксохромами. [43]
Заместитель ведет себя по-разному в зависимости от характера связи - экваториального или аксиального - с одним и тем же атомом углерода циклогексано-вого кольца ( О. [44]
Заместители у ненасыщенной углеродной цепи могут, разумеется, изменять как направление, так и скорость перегруппировки; эффекты этого рода будут рассмотрены ниже на конкретных примерах, но в общем можно считать, что сопряженные или сверхсопряженные группы стабилизируют двойные связи во многих отношениях так же, как при реакциях [ 5-элиминирования и анионотропном сдвиге. Электронный эффект, однако, противоположен наблюдающемуся при анионотропной перегруппировке, поскольку электронооттягивающие группы облегчают отрыв протона. [45]
Страницы: 1 2 3 4