Алкильный заместитель
Cтраница 3
Алкильные заместители в пиррольном ядре вызывают изменение сдвига соседних протонов на 0 2 - 0 3 млн-1 в сторону сильных полей, а для удаленных протонов - на 0 1 - 0 2 млн-1. Резонансные линии метальных и метиленовых групп, соседних с ацильны-ми или другими электроотрицательными заместителями, также смещаются в сторону слабых полей примерно на 0 3 млн-1. Эти сдвиги, как правило, аддитивны и часто бывают полезны при решении структурных вопросов. [31]
Алкильные заместители в - положении оказывают более ярко выраженное влияние. Увеличение а-замещен-ности, вероятно, облегчает гетеролиз связи С-X и сдвигает переходное состояние в направлении El, приводя к более стабильным продуктам. Как в -, так и в р-положении она может стабилизировать, путем сопряжения, двоесвязное переходное состояние и в - положении должна способствовать гетеролизу связи С-X. Дополнительное действие фенильной группы в р-положении несомненно обусловлено ее способностью стабилизировать повышенную электронную плотность и, возможно, сдвигать переходное состояние в сторону ElcB конца шкалы. Величина р Гаммета 2 15 для п-замещенных 2-фенилэтилбромидов также подтверждает преимущественный эффект электронного оттягивания из р-положения. Тем не менее, переходное состояние все же обладает, по-видимому, некоторым двоесвязным характером. Таким образом, индуктивный эффект р-заместителей может наблюдаться и в области со значительным двоесвязным характером. Возможно, что небольшой стабилизирующий эффект р-алкильной группы частично является результатом совместного действия неблагоприятного индуктивного эффекта и более сильного благоприятного эффекта по отношению к возникающей двойной связи. [32]
Алкильные заместители в таких системах оказывают небольшое, но постоянное влияние на их подвижность, степень которого зависит от расположения алкильной группы. Эти различия соответствуют индуктивному влиянию, которое уменьшается с расстоянием, и эффекту сверхсопряжения, который может действовать через систему двойных связей [193]; эти эффекты облегчают расщепление связи углерод - кислород. [33]
Алкильные заместители своим электронным и стерическим воздействием стремятся замедлить отрыв протона. Предпочтительный отрыв протона из незатрудненных положений ведет к образованию менее замещенного алкена. [34]
Алкильные заместители у С ( 2) и С ( 3 углеродных атомов диеновой системы, видимо, способствуют 1 4-присоединению, в то время как алкильное замещение у С ( 1) и С ( 1) атомов сопряженной диеновой системы приводит главным образом к 1 2-присоединению. Но в последнем случае реакция, по-видимому, больше зависит от природы реагента. [35]
Алкильные заместители имеют нормальное строение. [36]
Алкильные заместители облегчают, а ацильные, карбоксильные и фенильные группы тормозят этот тип расщепления. [37]
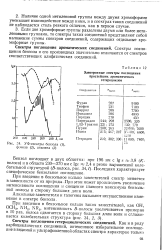 |
УФ-спектры бензола ( /, фенола ( 2, анилина ( 3. [38] |
Алкильные заместители и галогены вызывают несущественное изменение в спектре бензола. [39]
Алкильные заместители, хотя и играют значительную роль при ориентации атакующего ядра агента, не могут полностью определить направленность присоединения второго заместителя. Установлено, что чем реакционноспособнее алкилирующий агент, тем меньшая роль принадлежит заместителю в исходном соединении вследствие того, что реагент несет основную часть энергии, следовательно, его высокая реакционная способность предопределяет низкую избирательность. [40]
Алкильные заместители водорода в этилене вызывают увеличение интенсивности полос поглощения и смещение их в сторону длинных волн. Их действие качественно может быть разъяснено расчетами по методу молекулярных орбит. Анализ олефи-нов, содержащих изолированные двойные связи С С, на современных спектрофотометрах недоступен вследствие того, что наиболее длинноволновая полоса поглощения имеет малую интенсивность и лежит на коротковолновой границе области применения приборов. [41]
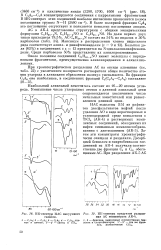 |
ИК-спектры НАС вакуумного [ IMAGE ] ИК-спектры продуктов разделе. [42] |
Наибольший алкильный заместитель состоит из 16 - 20 атомов углерода. [43]
Крупные алкильные заместители в молекулах алкилбензолов могут содержать более 30 углеродных атомов. [44]
Алкоксильные и алкильные заместители увеличивают скорость окисления олефина, а фенильная, сульфоксильиая и карбоксильная группы, а также группы N02, CN и Hal замедляют реакцию. Не все олефины удается окислить до их окисей подобным образом. Иногда окисление идет гораздо глубже и задержать его на стадии получения а-окиси не удается. Хотя кинетике и механизму окисления надкислотами посвящен целый ряд работ21, механизм эпоксидирования до сих пор до конца не ясен и нуждается в изучении. [45]
Страницы: 1 2 3 4