Электроноакцепторный заместитель
Cтраница 1
Электроноакцепторные заместители стабилизируют ароматическое кольцо, а электронодонорные облегчают процесс окислительного разрушения. [1]
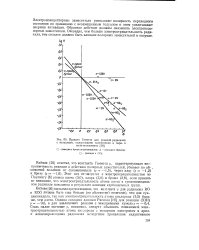 |
Правило Гаммета для реакций радикалов. [2] |
Электроноакцепторные заместители уменьшают полярность переходного состояния по сравнению с незамещенным толуолом и этим увеличивают энергию активации. Обратное действие должны оказывать электронодо-норные заместители. Очевидно, чем больше электроотрицательность радикала, тем сильнее должно быть влияние полярных заместителей в толуоле. [3]
Электроноакцепторные заместители в производных ацетилена способствуют протеканию р-ции. [4]
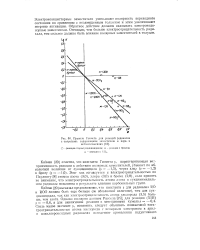 |
Правило Гаммста для реакций радикалов с толуолами, содержащими заместители в пара - и. [5] |
Электроноакцепторные заместители уменьшают полярность переходного состояния по сравнению с незамещенным толуолом и этим увеличивают энергию активации. Обратное действие должны оказывать электронодо-норные заместители. Очевидно, чем больше электроотрицательность радикала, тем сильнее должно быть влияние полярных заместителей в толуоле. [6]
Электроноакцепторные заместители в бензильной группе увеличивают электрофильностъ третичного с - углеродного атома и усиливают указанное взаимодействие. При этом жесткость переходного состояния возрастает, что приводит к существенной десольватации нуклеофильного центра. Десольватация, требующая затраты энергии, вызывает увеличение требуемой для осуществления реакции энтальпии активации. В свою очередь, освобождение замороженных у нуклеофильного центра молекул растворителя приводит к возрастанию энтропии активации, которая становится менее отрицательной. [7]
Электроноакцепторные заместители в К ускоряют р-цию. [8]
Электроноакцепторные заместители - М - типа должны уменьшать основность ароматического кольца и направлять присоединяющийся протон в мета-положение. Понижение основности ароматического кольца, естественно, затрудняет прямое наблюдение аренониевых ионов в связи с понижением их устойчивости. Кроме того, заместители - М - типа сами являются основными центрами, и поэтому в подобных случаях протон часто присоединяется к заместителю, а не к ароматическому кольцу. Наблюдать образование аренониевых ионов из соединений, содержащих заместители - М - типа, удается лишь в тех случаях, когда в молекуле одновременно имеются сильные элект-ронодонорные заместители. [9]
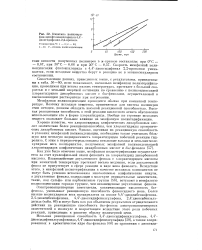 |
Кинетика полиэтери-фикации фталоилхлорида и 4 4 -диоксидифенил - 2 2-пропана Температура, С. 1 - 0. 2 - 30. 3 - 50. Р - степень поликонденсации. [10] |
Электроноакцепторные заместители, увеличивающие кислотность бис-фенола, уменьшают реакционную способность феноксидного иона. Более низкие молекулярные веса полиарилатов на основе 4 4 -диоксибензофенона, 2 4-диоксибензофенона, 4 4 -диоксидифенилсульфона, 2 4 диоксибензаль-дегида ( табл. 66) и могут быть как раз объяснены результатом отрицательного действия на реакционную способность б с-фенола электропоакцепторных заместителей в молекуле и возрастанием вследствие этого роли побочных реакций, приводящих к раннему обрыву полимерной цепи. [11]
Электроноакцепторные заместители ( например карбоксильная или нитро-группы) у двойной связи или вблизи нее препятствуют образованию нитрозо-хлоридов. [12]
Электроноакцепторные заместители в вини-логичном к хлору положении активизируют его. [13]
Электроноакцепторные заместители вызывают некоторое увеличение положительного заряда на атоме металла, делая его худшим cfrt - донором. [14]
Электроноакцепторные заместители в ароматическом кольце, содержащем сульфамидную группу, затрудняют эту реакцию, вероятно, за счет уменьшения и без того слабой основности атома азота; нуклеофильная атака по атому серы безусловно происходит после протонирования азота. Если атом азота несет объемистую группу, затрудняющую подход к сере, то действие воды может вызвать разрыв связи С - S, как это происходит при десульфи-ровании. [15]
Страницы: 1 2 3 4