Нуклеофильный заместитель
Cтраница 2
В этом случае, так же как и в пенталене, электрофильные и радикальные заместители должны направляться в а-поло-жение, а нуклеофильные заместители - в 3-положение; энергия резонанса составляет около 50 ккал / моль, так что молекула в целом сходна с молекулой пенталена. Гептален, так же как и пентален, вероятно, должен быть окрашен. [16]
В этом случае, так же как н в пенталене, электрофильные и радикальные заместители должны направляться в а-поло-жение, а нуклеофильные заместители - в 3-положение; энергия резонанса составляет около 50 ккал / моль, так что молекула в целом сходна с молекулой пенталена. Гептален, так же как и пентален, вероятно, должен быть окрашен. [17]
Однако, когда гидроксильная группа расположена при углероде, связанном кратной связью, и неподеленная пара электронов кислорода находится в сопряжении с л-электронами двойной или тройной связи, тогда гидроксильная группа проявляет свойства типичного нуклеофильного заместителя. [18]
Объясняется это тем, что электрофильные заместители, оттягивая к себе электроны, уменьшают электронную плотность на электрохимически активной группе ( центре нуклеофильной атаки электрона) и тем самым облегчают присоединение к ней электронов от элек-тродау а нуклеофильные заместители, повышая электронную плотность на активной группе, обусловливают противоположный эффект. Это эмпирическое правило было подтверждено многочисленными исследованиями и до сих пор остается полезным для приближенной оценки влияния заместителей на ЕЧ, электровосстановления. [19]
Объясняется это тем, что электрофильные заместители, оттягивая к себе электроны, уменьшают электронную плотность на электррхими-чески активной группе ( центре нуклеофильной атаки электрона) и тем самым облегчают присоединение к ней электронов от элек-трода а нуклеофильные заместители, повышая электронную плотность на активной группе, обусловливают противоположный эффект. Это эмпирическое правило было подтверждено многочисленными исследованиями и до сих пор остается полезным для приближенной оценки влияния заместителей на Еу, электровосстановления. [20]
Образование углерод-углеродной связи имеет место при синтезах нитрилов нуклеофильным обменом галогена или других ионов на цианид-ион. В тех случаях, когда вступающий нуклеофильный заместитель представляет собой енолят, главным направлением реакции будет С-алкилирова-ние. К реакциям этого типа относится алкилирование активных метилено-вых соединений. Феноляты претерпевают главным образом О-алкилиро-вание, но известны также и случаи С-алкилирования. [21]
Установлено, что природа и полярные свойства заместителей в арилах определяют эффективность защиты от коррозии стали под напряжением. Максимальное защитное действие обеспечивается при введении сильных нуклеофильных заместителей. Оптимальные ингибирующие составы должны максимально подавлять водородную деполяризацию и наводороживание. [22]
Образование карбениевого иона при использовании некоторых реагентов проходит чрезвычайно легко вследствие устойчивости катиона. Действительно, в определенных случаях алкилирование аренов с сильными нуклеофильными заместителями, например фенолов и ариламинов, проходит без катализатора. [23]
Соотношение между актами распада и сшивания зависит от структуры эластомера и температуры реакции. В случае эластомеров, построенных из звеньев 1 4 с нуклеофильными заместителями, преобладают акты распада; для полибутадиенов и его сополимеров - сшивание вследствие указанной выше реакции передачи цепи. Для эластомеров, содержащих звенья 1 2, процесс сшивания выражен в еще большей степени. Для последних характерно то, что из-за наличия двойных связей в боковых группах деструкция не затрагивает главной цепи эластомера. [24]
Заместители по их направляющему действию, следовательно, можно разделить на две группы: к заместителям первого рода, направляющим в орто - и пара-положения, относятся галоиды, алкилы, ОН, SH, МН2, ОСНэ. N ( CH3) 2, CHjOH и др. Это электронодонорные или нуклеофильные заместители. [25]
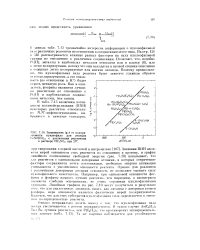 |
Зависимость lg k от поляризуемости нуклеофила для реакции r oNO ( CO3 с различными реагентами в растворе CH3N02 при 25. [26] |
Значения ППН являются мерой основности этих реагентов по отношению к протону, и график линейного соотношения свободной энергии ( рис. 7.10) показывает, что для реагентов с одинаковыми донорными атомами, в которых стерические факторы сохраняются почти постоянными, свободная энергия активации уменьшается с увеличением основности реагента. Однако для реагентов с различными донорными атомами основность не позволяет оценить силу нуклеофильного заместителя. Например, при одинаковой основности фос-финьг и фосфиты намного лучшие реагенты, чем пиридины, а изонитрилы являются слабыми основаниями, но очень хорошими нуклеофилыгами группами. Линейные графики на рис. 7.10 могут получаться в результате того, что для аналогичных лигандов, таких, как лиганды с донорным атомом фосфора, мера основности является фактически мерой поляризуемости. Кажется, что для этих субстратов нуклеофнльная сила определяется в основном поляризуемостью реагента. [27]
Алкилхлориды и алкилендихлориды обычно достаточно легкодоступны. Однако превращению этих хлоридов в другие полезные продукты мешает малая скорость реакции замещения атомов хлора на нуклеофильный заместитель ( реакция 5м2) в гидроксилсодержащих растворителях. Реакция идет с низким выходом, требует много времени и осуществляется под давлением в автоклавах. [28]
Алкилхлориды и алкилендихлориды обычно достаточно легкодоступны. Однако превращению этих хлоридов в другие полезные продукты мешает малая скорость реакции замещения атомов хлора на нуклеофильный заместитель ( реакция 5м2) в гидроксилсодержащих растворителях. Реакция идет с низким выходом, требует много времени и осуществляется под давлением в автоклавах. [29]
Например, замещение молекул СО и Мо ( СО) 6 разными фосфинами и аммин-ными реагентами протекает с константой скорости k - 6 - 10 - 5 сек 1 при 98 в смеси w - декан - циклогексан. Скорости соответствуют реакции первого порядка по концентрации М ( СО) в и не зависят от нуклеофильного заместителя. С реагентами-дающими л-связь, такими, как бензол, мезителен и нор-борнадиен, скорости реакций также не зависят от концентрации реагента, но меняются для различных реагентов. Эти результаты усложняются экспериментальной трудностью удаления СО, которое сопровождается потерей Мо ( СО) 6 при таких высоких температурах. [30]
Страницы: 1 2 3 4