Остальной заместитель
Cтраница 3
В систематической номенклатуре лактоны гидроксикислот называют, добавляя окончание - олид к названию соответствующего алкана, считая также углеродный атом карбоксильной группы. Положение гидроксильной группы обозначается соответствующей цифрой, остальные заместители, а также кратные связи называют согласно общим правилам. Систематические названия у-бутиролактона и б-валеролакто-на - 4-бутанолид и 5-пентанолид. [31]
В полизамещенных бензолах нумерацию начинают от того атома углерода, с которым связан заместитель, имеющий наименьшее число углеродных атомов. Направление нумерации должно быть таким, чтобы остальные заместители получили наименьшие номера. [32]
Что касается соединений с у - и более далеким положением ( относительно атома кремния) кратной связи, то они, также легко присоединяя галоген, образуют устойчивые дигалогенпроизводные. Термическая стойкость получаемых дигалогеналкилсиланов в значительной степени зависит от природы остальных заместителей у атома кремния. Наличие трихлорсилилыной группы резко увеличивает термическую стабильность даже 3 у-дихлоралкилсиланов. Например, С1з51СН2СНВгСН2Вг вполне стабильное соединение, в то время как R3SiCH2CHBrCH2Br распадается за несколько минут при комнатной температуре. [33]
В ряду ароматических гидроксильных кислот, так же как и в ряду карбоновых кислот, заместитель, стоящий в ж-положе-нии, проявляет индукционное влияние в чистом виде. Как видно из данных табл. 8.4, метальная группа проявляет / эффект, остальные заместители - / эффект. Заместитель, находящийся в я-положении, проявляет как эффект сопряжения, так и индукционный. Как и для ароматических карбоновых кислот, если знаки обоих эффектов совпадают, заместитель в я-положении оказывает на кислотность большее влияние, чем тот же заместитель, находящийся в ж-положении. Фенолы с такими сильными электроноакцепторными заместителями ( - / и - Т эффекты), как - N02, - CN и - SO2CH3, характеризуются исключительно низкими значениями рКа - Интересно отметить, что увеличение кислотной ионизации фенола под влиянием этих заместителей происходит в гораздо большей степени, чем при введении этих же заместителей в - положение молекулы бензойной кислоты. Это можно объяснить тем, что способность фенолят-аниона к сопряжению гораздо больше, чем у бензоат-аниона, и поэтому электронная поляризация в первом случае протекает исключительно эффективно. В тех случаях, когда / и Т эффекты имеют противоположные знаки ( это характерно для галогена и мето-ксильной группы), относительную силу этих эффектов можно оценить, измеряя константу ионизации. [34]
В ряду ароматических гидроксильных кислот, так же как и в ряду карбоновых кислот, заместитель, стоящий в ж-положе-нии, проявляет индукционное влияние в чистом виде. Как видно из данных табл. 8.4, метальная группа проявляет / эффект, остальные заместители - / эффект. Заместитель, находящийся в п-положении, проявляет как эффект сопряжения, так и индукционный. Как и для ароматических карбоновых кислот, если знаки обоих эффектов совпадают, заместитель в п-положении оказывает на кислотность большее влияние, чем тот же заместитель, находящийся в м-положении. Фенолы с такими сильными электроноакцепторными заместителями ( - / и - Т эффекты), как - N02, - CN и - SO2CH3, характеризуются исключительно низкими значениями рКа - Интересно отметить, что увеличение кислотной ионизации фенола под влиянием этих заместителей происходит в гораздо большей степени, чем при введении этих же заместителей в n - положение молекулы бензойной кислоты. Это можно объяснить тем, что способность фенолят-аниона к сопряжению гораздо больше, чем у бензоат-аниона, и поэтому электронная поляризация в первом случае протекает исключительно эффективно. В тех случаях, когда / и Т эффекты имеют противоположные знаки ( это характерно для галогена и мето-ксильной группы), относительную силу этих эффектов можно оценить, измеряя константу ионизации. [35]
В отличие от транс-транс-изомера диена ( I) цис-транс-1 4-диметилбутадиен ( II) конденсируется с малеиновым ангидридом только при относительно жестких условиях ( 150, 15 час. XVIII), в котором одна метильная группа занимает трансположение по отношению ко всем остальным заместителям в цикле. Из аддукта с хлорангидридом фумаровой кислоты был выделен после гидролиза и другой возможный изомер транс-кислоты ( XX), в котором соседние метальные и карбоксильные группы занимают цис-положение друг к другу. Последний, недостающий изомер ( XXI) получен термической изомеризацией ангидрида ( XVI) в гидрированной форме. Таким образом, оба известных геометрических изомера 1 4-диметилбутадиена ( I) и ( II) в диеновых конденсациях ведут себя совершенно различно. В то время как транстранс-1 4-диметилбутадиен ( I) легко образует аддукты, транс-цис-изомер ( II), даже с малеиновым ангидридом, конденсируется только при жестких условиях. [36]
В свете результатов, изложенных выше при обсуждении гипер-конъюгационной модели, можно высказать сомнение, что Es или El отличаются от Es именно из-за учета гиперконъюгационной составляющей и по этой причине более предпочтительны, чем последние. Приведенная конформационная модель позволяет учесть соответствующую поправку, однако, последующий пересчет значений стерических постоянных для всех остальных заместителей может рассматриваться как совершенно произвольная процедура. [37]
 |
Собственные названия ключевых соединений. [38] |
Правила, согласно которым тот или иной заместитель обозначается суффиксом или префиксом, твердо не установлены и различаются в разных странах. В данной книге суффиксами обозначены только двойные связи, окси -, кето - и кар-боксигрушш, а все остальные заместители обозначаются префиксами и располагаются в порядке номеров атомов углерода, к которым они присоединены. Исключение составляют только карденолиды, все заместители в которых обозначаются префиксами. [39]
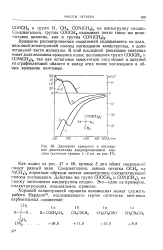 |
Дисперсия вращения и поглощение диметиламида азидопропионовой кислоты ( значение кривых / - 5 на 47. [40] |
Вращение рассматриваемых соединений складывается из доли, вносимой анизотропией полосы поглощения азидогруппы, и доли остальной части молекулы. В этой последней решающее значение имеет доля величины вращения полос поглощения групп СООСН3 и GON ( GH3) 2, так как остальные заместители поглощают в дальней ультрафиолетовой области и вклад этих полос поглощения в общее вращение ничтожен. [41]
При использовании аддитивной схемы углеродный скелет молекулы пронумеровывают. Затем из табл. 2 берутся константы заместителей углеродного скелета. Положение остальных заместителей соответствует вышеупомянутой нумерации. [42]
Поскольку речь идет о химической стабильности связи Si-С, то дать ей общую характеристику невозможно. Рассмотрим ранее приведенный пример необыкновенной устойчивости тетра-метилсилана к действию концентрированной серной кислоты и противоположный ему пример легкого гидролитического расщепления связи - С-С - Si. Здесь решающим оказывается поведение органического радикала, связанного с кремнием, поведение других реагентов, условия реакции и влияние остальных заместителей. [43]
Реакционная способность трех гидроксилов неодинакова. Изучение этерификации целлюлозы в гомогенной среде с помощью n - толуолсульфокислоты показывает, что вторичные спиртовые группы в положении 3 наименее реакционноопособ-ны, в то время как реакционная способность первичной спиртовой группы вдвое больше. Галоидирование реакционноспособ-ных групп в положении 6 позволяет к тому же определить количество первичных функциональных групп в частично замещенном эфире ( Пурвес, Мальм), в то время как расположение остальных заместителей может быть определено анализом полностью деполимеризованного производного. Возможно, наконец, что на скорость реакции влияет соседство уже замещенной группы в том же элементарном звене. [44]
Обработка данных, согласно уравнению ( VIII. Для сравнения на этот же график нанесены точки, соответствующие а 0, что равносильно предположению о неучастии в гиперконъюгации С-С - связей. В последнем случае из графического анализа выпадает точка для ( СН3) зС ( н 0), но соответствующая величина рКа может быть рассчитана, исходя из найденного для остальных заместителей значения р, а затем сравнена с экспериментом. [45]
Страницы: 1 2 3 4