Метильный заместитель
Cтраница 3
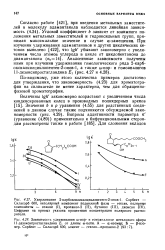
Это равносильно предположению, что влияние метильных заместителей не передается через связь Аг-Аг в таких производных дифенила. Это может быть в лучшем случае приближением. [31]
Однако известны определенные благоприятствующие положения для метильных заместителей. Некоторое значение имеет электронный характер заместителя. [32]
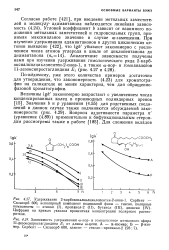
Иначе обстоит дело при введении двух метильных заместителей в положения 3 и 5 в кольцо, содержащее группу CN. Введение метальной группы лишь незначительно уменьшает кислотность благодаря линейной структуре группы С N; анион стабилизуется вследствие резонанса. [33]
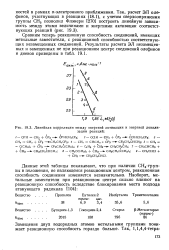 |
Линейная корреляция между энергией активации и энергией локализации реакций. [34] |
Сравним теперь реакционную способность соединений, имеющих метильные заместители, с реакционной способностью соответствующих незамещенных соединений. [35]
Угловой коэффициент Ъ зависит от взаимного положения метильных заместителей и гидроксильных групп, принимая максимальное значение в случае а-замещения. [37]
Угловой коэффициент b зависит от взаимного положения метильных заместителей и гидроксильных групп, принимая максимальное значение в случае ос-замещения. [39]
Характерно также то, что пространственная конфигурация метильных заместителей, не участвующих в реакции ( например, у атомов G-1 и G-2), остается в основном без изменения. [40]
Замена в циклопентановых углеводородах хотя бы одного метильного заместителя на этильный резко изменяет направление реакции в сторону образования гексаметиленовых углеводородов, в том числе и геле-замещенных. Соответствующие превращения уже были рассмотрены нами ранее. [41]
Аналогично рассмотренному выше протекает протонный обмен в метильных заместителях изотиазола: метильные группы в положении 5 депротонируются быстрее, чем в положении 3, а в 4-ме-тильной группе обмен практически не происходит. [42]
Уже отмечалось, что если в цепи один метильный заместитель, такая миграция осуществляется относительно быстро. [43]
Следует особо обратить внимание на весьма далекую миграцию метильного заместителя по согласованному механизму. [44]
В схеме ( I) промежуточно образующийся ион имеет метильный заместитель в семичленном цикле и путем сжатия цикла превращается в этилдекалин. В схеме ( II) промежуточно образующийся ион уже не содержит метильного заместителя в семичленном цикле и изомеризация протекает с образованием диметилдека-линов. [45]
Страницы: 1 2 3 4