Природа - переходное состояние
Cтраница 4
По тем же причинам при обратной реакции - гидролизе сложных эфиров, также идущей через тетраэдрический интермедиат, с-изомер оказывается менее реакционноспособным, чем транс-изомер. Однако нельзя считать, что таково общее правило; все зависит от конкретной реакции, от природы переходных состояний. [46]
Вместе с тем, как отмечено во Введении, наибольший интерес представляет изучение реакционной способности рассмотренных координированных лигандов. Из работ, близких к такому направлению [106-109], сделан в наиболее общей форме следующий вывод: координация не изменяет ориентации заместителя, входящего в органическую часть лиганда, но, оказывая влияние на природу переходного состояния, может вызвать значительные изменения в скорости реакции. [47]
Однако современных знаний о состоянии твердых поверхностей недостаточно, чтобы слишком полагаться на их результаты. Природа поверхностного переходного состояния не может быть определена достаточно точно. [48]
Как уже отмечалось, в газовой фазе, в отличие от раствора, реагирующая молекула может использовать только свои внутренние ресурсы; не может быть и речи, по крайней мере при обычных давлениях, о совместных действиях с другими молекулами. Поэтому в газовой фазе должна быть особенно заметна роль заместителей. Ключ к природе переходного состояния дает тот факт, что и а -, и - заместители влияют на связь углерод - галоген, а также аналогия с реакциями Е и SN [ в растворе. Обе эти реакции протекают через переходное состояние, включающее общий карбониевый ион. В свете современных теорий молекулярных реакций в газовой фазе можно думать, что переходное состояние возникает в результате перераспределения энергии внутри молекулы, ведущего к концентрации энергии по связи углерод - галоген. [49]
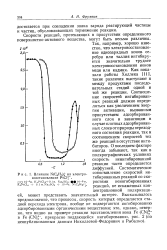 |
Влияние N ( C4Hs t на электровосстановление PtCli. СО Ю-3 н. K. PiCU - н. NaoSOdi 10 - Зн. KsPtClj 0. 1 н. Г таг5О4 fo - з н. NiCjHc. [50] |
Так, например, хорошо известно, что электровосстановление однозарядных ионов серебра или таллия ингибиру-ется значительно труднее электровосстановления ионов меди или кадмия. Как показали работы Холлека [11], такие различия выступают и между продуктами последовательных стадий одной и той же реакции. Соотношение скоростей ингибирован-ных реакций должно определяться как увеличением энергии активации, вызванным присутствием адсорбированного слоя и зависящим в случае плотных адсорбированных слоев от природы переходного состояния реакции, так и соотношением скоростей тех же реакций в отсутствие ингибиторов. О последнем факторе иногда забывают, так как в полярографических условиях скорость неингибированной реакции часто определяется диффузией. Систематическое сопоставление скоростей ин-гибированных реакций со скоростями неингибированных реакций, не искаженных концентрационной поляризацией, может представить значительный интерес. [51]
 |
Влияние заместителей у атома фосфора. [52] |
Замена алкильного остатка на алкоксигруппу несомненно снижает скорость щелочного гидролиза, хотя и не в такой степени, как в случае соответствующих карбонильных соединений. Следует подчеркнуть важность использования гомоморфных соединений [ 27, с. Любая попытка объяснения экспериментальных данных с позиций простого электронного влияния должна рассматриваться как упрощенный подход, поскольку при этом не учитываются возможные изменения в природе переходного состояния, возникающего при замене нуклеофила или при изменении числа фосфор-углеродных связей в молекуле. [53]
Экспериментальные скорости около половины бимолекулярных газовых реакций хорошо совпадают с величинами, вычисленными по теории столкновений, для бимолекулярных реакций в растворах это совпадение немного хуже. Впервые очень сильное уменьшение экспериментальных скоростей реакций по сравнению с расчетными величинами уравнения Мак-Льюиса ( 8) наблюдал в 1924 г. Христиансен для бимолекулярных органических реакций в растворе. Предложенное Христиан-сеном объяснение этого явления, как результата дезактивации молекул растворенного вещества при их столкновении с растворителем, поддержанное некоторыми физико-химиками, было опровергнуто открытием в начале 30 - х годов XX в. Правильное решение этой задачи было невозможно без раскрытия природы переходного состояния. [54]
Бенсон [24] считает, что в случае реакций между диполь-ными молекулами электростатические взаимодействия между реагентами имеют тот же порядок величины, что и вандервааль-совы силы. Он полагает, что пренебрежение вандерваальсовыми силами является слишком большим упрощением в случае таких реагентов. Он сомневается в том, что корреляция между диэлектрической проницаемостью растворителя и скоростью реакции между дипольными молекулами может пролить много света как на природу переходного состояния, так и на теорию растворов. [55]
Степень участия имеющихся в олефине заместителей в создании карбкатионного состояния уменьшается по мере того, как проявляет свое влияние как соседней группы вступающий заместитель X. Это значит, что константа реакции р должна быть тем меньше, чем симметричнее мостиковый карбкатион. В модифицированном уравнении Гаммета lg k aaj PCFR - f - fc0 первый член преобладает a р, локализованный эффект) при реакциях, идущих через трехзвенное переходное состояние. Очень интересная возможность установить природу переходного состояния с помощью корреляционных уравнений состоит в том, что в реакциях этиленов типа R1RiCCR3R4 влияние заместителей оценивают не суммарно, а для каждого С-атома в отдельности. [56]
Если существует некий путь между реагентами и продуктами, которому отвечает более низкий максимум энергии, чей любым другим, то именно по этому пути и пойдет реакция. Именно этот путь и наносят на диаграмму потенциальной энергии. Кривая на графике потенциальной энергии представляет собой этот путь с наименьшей энергией, проходящий через поверхность, которая может быть построена путем рассмотрения зависимости энергии от изменения пространственного расположения атомов, участвующих в реакции. Из теории переходного состояния естественно вытекает принцип микроскопической обратимости, согласно которому тот же самый путь, который реакция проходит в прямом направлении, может быть пройден и в обратном направлении, так как он отвечает самым низкам барьерам энергии для обоих процессов. Следовательно, информация о природе переходного состояния или интермедиата, полученная при исследовании прямой реакции, применима и к обсуждению обратного процесса, происходящего в тех же условиях. [57]
При использовании проволоки в виде спирали многие молекулы, покидающие горячую поверхность, не прореагировав, вновь ударяются о горячую поверхность. При этом встает вопрос о том, будут ли такие молекулы реагировать при повторном ударе более легко, чем при первом. При исследовании реакции этана на вольфраме Стоун сравнивал скорости реакции на плотно намотанной спирали и на прямой проволоке и не обнаружил различия. При повторных столкновениях реакционная способность молекул этана не увеличивается. По-видимому, природа переходного состояния не зависит в значительной степени от температуры молекул, ударяющихся о горячую каталитическую поверхность. [58]
Страницы: 1 2 3 4