Химическая природа - элемент
Cтраница 1
Химическая природа элемента обусловливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону. [1]
Химическая природа элемента обусловливается способностью его атома терять и, приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством, к электрону. [2]
Химическая природа элемента обусловливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к, электрону. [3]
Химическая природа элемента обусловливается способностью его j атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону. [4]
Химическая природа элемента обусловливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону. [5]
Изменяется ли химическая природа элемента при испускании у-лучей его ядрами. [6]
Изменяется ли химическая природа элемента при испускании у-излучеиия его ядрами. [7]
Изменяется ли химическая природа элемента при испускании у-лучей его ядрами. [8]
Изменяется ли химическая природа элемента при испускании 7 Лучей его ядрами. [9]
Изменяется ли химическая природа элемента тфи испускании у-дучей его ядрами. [10]
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений, в частности их основно-кислотная активность. Так, в случае оксидов в ряду Li20 - BeO - B2O3 - CO2 - N2O5 по мере уменьшения степени полярности связи ( уменьшения отрицательного эффективного заряда атома кислорода 8) ослабляются основные и нарастают кислотные свойства: Li2O - сильно основной оксид, ВеО - амфотерный, а В2Оз, СО2 и N2O5 - кислотные. [11]
В соответствии с изменением химической природы элементов закономерно изменяются и химические свойства соединений. Так, в случае оксидов в ряду Li2O - ВеО - В2О3 - - СО2 - N2O5 по мере уменьшения степени полярности связи ослабляются основные и нарастают кислотные свойства: Li2O - основной оксид, ВеО - амфотерный, а В2О3, СО2 и N2O5 - кислотные. [12]
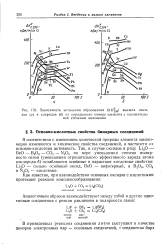 |
Зависимость энтальпии образования ( ДЯ дд высших оксидов ( а и хлоридов ( б от порядкового номера элемента с положительной степенью окисления. [13] |
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений, в частности их основно-кислотная активность. Так, в случае оксидов в ряду Li2O - ВеО - В2О3 - СО2 - N2O5 по мере уменьшения степени полярности связи ( уменьшения отрицательного эффективного заряда атома кислорода 6) ослабляются основные и нарастают кислотные свойства: Li2O - сильно основный оксид, ВеО - амфотерный, а В2О3, СО2 и N2O5 - кислотные. [14]
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений, в частности их основно-кислотная активность. Так, в случае оксидов в ряду Li2O - ВеО - В2О3 - СО2 - N2O6 по мере уменьшения степени полярности связи ( уменьшения отрицательного эффективного заряда атома кислорода 6) ослабляются основные и нарастают кислотные свойства: Li2O - сильно основный оксид, ВеО - амфотерный, а В2О3, СО2 и N2O5 - кислотные. [15]
Страницы: 1 2 3 4